
(共12分)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
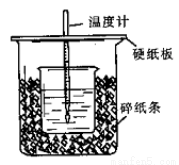
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”)
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”“偏小”“无影响”) 。
(6)写出NaOH溶液和盐酸反应表示中和热的热化学方程式 。
科目:高中化学 来源:2016届安徽省高三第一次联考化学试卷(解析版) 题型:选择题
阿托酸是一种常用的医药中间体,其结构如图所示: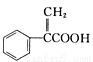 。下列有关说法正确的是
。下列有关说法正确的是
A.阿托酸的分子式为C9 H8O2
B.lmol阿托酸最多能和4mol Br2发生加成反应
C.阿托酸分子中所有碳原子一定在同一平面
D.阿托酸能发生取代、加成、水解等反应
查看答案和解析>>
科目:高中化学 来源:2016届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下性质错误的是
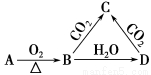
A.溶液呈碱性 B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体 D.受热易分解
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省天水市高三上第一次检测考试化学试卷(解析版) 题型:填空题
(10分)氧化还原反应在生产、生活中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂.用所学知识回答问题:
(1) 3H2SO4+2 KMnO4+5H2O2=K2SO4+2MnSO4+5 O2↑+8 H2O,当有6 mol H2SO4参加反应的过程中,有 mol还原剂被氧化。
(2)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为 .
(3)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷(解析版) 题型:实验题
(11分)为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)

(1)将仪器连接好以后,必须进行的第一步操作是_________ ____。
(2)此实验还必须用到的最重要的仪器是_______;仪器F的作用是_______。
(3)已知仪器C中装有品红溶液,其作用是________ ___。
(4)实验室中备有以下常用试剂:
a.浓硫酸
b.酸性高锰酸钾溶液
c.品红溶液
d.饱和碳酸氢钠溶液
e.氢氧化钠溶液
f.碱石灰
g.无水硫酸铜
h.五氧化二磷
i.无水氯化钙
①请将下列容器中应盛放的试剂序号填入相应空格:B中______,D中______,E中______。
②实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是_____。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”、“偏低”或“没影响”)。
(5)若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省三门峡市高二上学期入学考试化学试卷(解析版) 题型:选择题
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
A.通入大量O2 B.增大容器容积
C.移去部分SO3 D.降低体系温度
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
已知H—H键能为436 kJ·mol-1,H—N键能为391 kJ·mol-1,根据化学方程式:
N2+3H2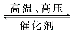 2NH3 ΔH=-92.4 kJ·mol-1,则N≡N键的键能是
2NH3 ΔH=-92.4 kJ·mol-1,则N≡N键的键能是
A.431 kJ·mol-1 B.946 kJ·mol-1
C.649 kJ·mol-1 D.869 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省双鸭山市高三上第一次月考化学试卷(解析版) 题型:填空题
(14分)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。
(1)工业制硫酸铜的方法很多。
①方法一、用浓硫酸和铜制取硫酸铜。该反应的化学方程式是_____ _,此法的最大缺点是_ ______。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示:

稀硫酸、铜和氧化铁反应的离子方程式是__ __;向混合溶液中通入热空气的反应的离子方程式是_ ____;由滤液得到无水硫酸铜的实验操作是 ______。
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵。主要的工艺流程如下图所示:

①吸收塔中发生反应的化学方程式是____ ___。
②有数据表明,吸收塔中溶液的pH在5.5~6.0之间,生产效率较高。当控制一定流量的尾气时,调节溶液的pH的简便方法是___ ____。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期入学考试化学试卷(解析版) 题型:填空题
(15分)化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
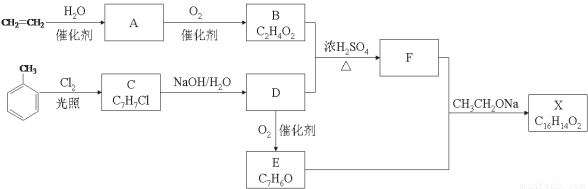
已知:RX ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’ 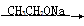 RCH=CHCOOR’
RCH=CHCOOR’
请回答:
(1)E中官能团的名称是 。
(2)B+D→F的化学方程式 。
(3)X的结构简式 。
(4)对于化合物X,下列说法正确的是 。
A.能发生水解反应 B.不与浓硝酸发生取代反应
C.能使Br2/CCl4溶液褪色 D.能发生银镜反应
(5)下列化合物中属于F的同分异构体的是 。
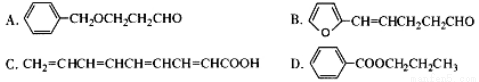
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com