
| A. | 0.1 mol•L-1的CH3COOH溶液中,由水电离的c(H+)为10-13 mol•L-1 | |
| B. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| C. | 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 1 mol醋酸分子中含有共价键的个数为8NA |
分析 A.酸溶液中存在离子积常数,0.1 mol•L-1的CH3COOH溶液中氢离子浓度小于0.1mol/L;
B.pH=2醋酸溶液中氢离子浓度为10-2mol/L,pH=1的溶液中氢离子浓度为10-1mol/L;
C.等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,醋酸是弱电解质存在大量平衡,反应后又电离出氢离子溶液显酸性;
D.1个醋酸分子CH3COOH中含有共价键的个数为8个;
解答 解:A.酸溶液中存在离子积常数,0.1 mol•L-1的CH3COOH溶液中氢离子浓度小于0.1mol/L,由水电离的c(H+)大于10-13 mol•L-1,故A错误;
B.pH=2醋酸溶液中氢离子浓度为10-2mol/L,pH=1的溶液中氢离子浓度为10-1mol/L,pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10,故B正确;
C.等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,醋酸是弱电解质存在大量平衡,反应后又电离出氢离子溶液显酸性,pH<7,故C正确;
D.1个醋酸分子CH3COOH中含有共价键的个数为8个,1 mol醋酸分子中含有共价键的个数为8NA,故D正确;
故选A.
点评 本题考查了电解质溶液中离子浓度大小比较,酸碱反应后溶液酸碱性的判断,注意弱电解质的电离平衡,题目难度中等.


科目:高中化学 来源: 题型:解答题
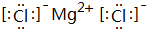 ,其中所含化学键的类型是离子键.
,其中所含化学键的类型是离子键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3 Fe2O3 | B. | Fe(OH)2 Fe2O3 | C. | Fe(OH)2 Fe(OH)3 | D. | Fe(OH)2 Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 大理石溶解于硝酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 向NaAlO2溶液中通入足量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | Fe与稀HNO3反应:Fe+2H+═Fe2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的稳定性:甲>乙>丙 | |
| B. | 甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙 | |
| C. | 原子半径的大小:甲>乙 | |
| D. | 乙元素的族序数比甲元素的族序数大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com