
| A. | NH3、CH4的分子数之比为1:1 | B. | NH3、CH4两种气体的密度之比为a:b | ||
| C. | NH3、CH4的摩尔质量之比为17:16 | D. | NH3、CH4的物质的量之比为a:b |
分析 25℃、101KPa时,agNH3与bgCH4的体积相同,则物质的量相同,结合物质的量的公式计算.
解答 解:25℃、101KPa时,agNH3与bgCH4的体积相同,则NH3、CH4的物质的量相同,
A.NH3、CH4的物质的量相同,由N=nNA可知,NH3、CH4的分子数之比为1:1,故A正确;
B.NH3、CH4两种气体的密度之比为$\frac{a}{V}$:$\frac{b}{V}$=a:b,故B正确;
C.NH3、CH4的摩尔质量之比为17:16,故C正确;
D.NH3、CH4的物质的量相同,故D错误.
故选D.
点评 本题考查阿伏加德罗定律及推论,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意物质的量与体积、原子数目的计算公式的运用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
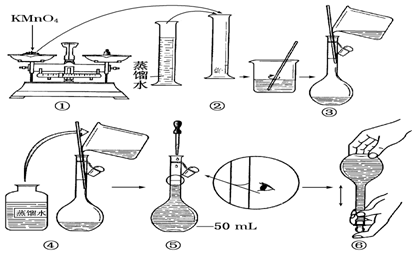
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
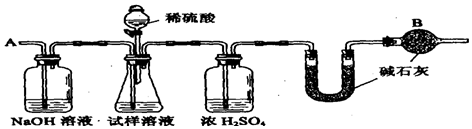
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
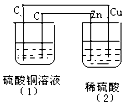 如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上通过了0.02mole-.若不考虑溶液体积的变化,下列叙述正确的( )
如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上通过了0.02mole-.若不考虑溶液体积的变化,下列叙述正确的( )| A. | 相同条件下,两容器产生的气体体积相同 | |
| B. | (1)、(2)溶液的pH值均减小 | |
| C. | (1)中阳极电极反应方程式为:4OH--4e-═2H2O+O2↑ | |
| D. | (2)中正极反应为Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在点燃易燃气体前,必须检验气体的纯度 | |
| B. | 浓酸对皮肤有腐蚀性,如不慎沾到皮肤上,应用较多的水冲洗,再涂上硼酸稀溶液 | |
| C. | 在稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒搅拌 | |
| D. | 不得点燃添满酒精的酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O中含NA个质子 | |
| B. | 1 L 1 mol•L-1的CuSO4溶液中含NA个Cu2+ | |
| C. | 常温常压下,2.24 L Cl2中含0.2NA个氯原子 | |
| D. | 0.5 mol Al与足量NaOH溶液充分反应,转移的电子数目为1.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com