
下列化学用语不能正确表示相应粒子的是
A.HClO的电子式:
B.C2H6的结构简式:CH3CH3
C.CO2的结构式:O=C=O
D.O2-的结构示意图:
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作 | 实验目的或结论 |
A | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是K2CO3 |
B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
C | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 | 说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
D | C2H5OH与浓硫酸170 ℃共热,制得的气体通入酸性KMnO4溶液 | 检验制得气体是否为乙烯 |
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
化学科学需要借助化学专用语言来描述,下列化学用语的书写正确的是
A. B.
B.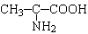
C.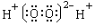 D.OHCCHO
D.OHCCHO
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
关于苹果酸(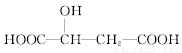 )说法正确的是
)说法正确的是
A.苹果酸不易溶于水而易溶于有机溶剂
B.和苹果酸具有相同官能团的同分异构体只有1种
C.1 mol苹果酸与足量NaOH溶液反应时,最多消耗3 mol NaOH
D.1mol苹果酸与足量NaHCO3溶液反应时,最多可得44.8LCO2(标准状况下)
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法不正确的是
A.标准状况下,22.4 L O2含有的分子数为NA
B.常温常压下,3.4 g H2O2含有极性键的数目为0.2 NA
C.将含Na+数目为NA的NaCl固体溶于1 L水中,所得溶液的浓度为1 mol·L-1
D.标准状况下,2.24 L Cl2与足量NaOH溶液反应,转移电子的数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源:2015届北京市东城区普通校高三11月联考化学试卷(解析版) 题型:选择题
某未知溶液中已检验出含有离子Ca2+、NO3-,且pH=2。欲检验此溶液中是否大量存在以下6种离子:①ClO- ②NH4+ ③I- ④Fe2+ ⑤AlO2- ⑥Cl-,其中不必检验就能排除的离子是
A.②③⑤⑥ B.①③④⑤
C.①④⑤⑥ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:填空题
(本小题14分)氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛。
(1)图中表示两个常见的固氮反应:
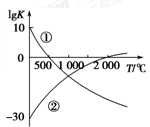
①N2+3H2 2NH3
2NH3
②N2+O2 2NO的平衡常数(lg K)与温度的关系,
2NO的平衡常数(lg K)与温度的关系,
根据图中的数据判断下列说法正确的是________(填序号)。
A.反应②为放热反应
B.常温下,反应①的反应速率很大,而反应②的反应速率很小
C.升高温度,反应①的反应速率增大,反应②的反应速率减小
D.在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
(2)工业上也可在碱性溶液中通过电解的方法实现由N2制取NH3:2N2+6H2O 4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ____。
4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ____。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应:
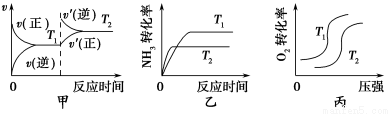
①N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+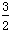 O2(g) ΔH=a kJ/mol。
O2(g) ΔH=a kJ/mol。
已知:②N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol,
2NH3(g) ΔH=-92.4 kJ/mol,
2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。
2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。
(4)已知:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1 ,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1 ,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
①当温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。
②该燃料电池的负极反应式是____________________________________。
(5)工业上合成氨时,温度过高,氨气的产率降低,试从化学平衡移动原理的角度加以解释:__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:填空题
(15分)(物质结构与性质)金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为: 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C (填“>”或“<”,下同)B;第一电离能:N O 。
(3)月球岩石——玄武岩的主要成分为钛硫酸亚铁 与80%的硫酸反应可生成
与80%的硫酸反应可生成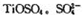 的空间构型为 形,其中硫原子采用 杂化。
的空间构型为 形,其中硫原子采用 杂化。
(4)磷酸肽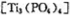 锂离子电池能来那个密度大、安全性高。
锂离子电池能来那个密度大、安全性高。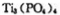 可由
可由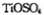 与
与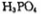 反应制得。两分子
反应制得。两分子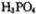 发生脱水生成焦磷酸:
发生脱水生成焦磷酸:
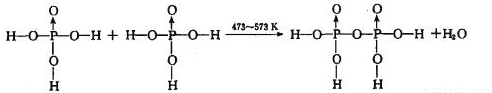
则三分子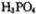 脱去两分子
脱去两分子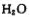 生成三磷酸,其结构式为 ,四分子
生成三磷酸,其结构式为 ,四分子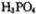 脱去四分子
脱去四分子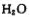 生成的四偏磷酸属于 元酸。
生成的四偏磷酸属于 元酸。
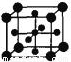
(5)Ti的氧化物和CaO相互作用能形成太酸盐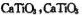 的晶体结构如图所示(Ti位于立方体的顶点)。该晶体中Ti4+和周围 个O2-紧邻。
的晶体结构如图所示(Ti位于立方体的顶点)。该晶体中Ti4+和周围 个O2-紧邻。
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中
实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重
大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为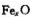 (x<1),若测得某
(x<1),若测得某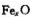 晶体密度为5.71g·cm-3,晶胞边长为4.28×
晶体密度为5.71g·cm-3,晶胞边长为4.28×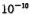 m,则
m,则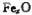 中x= 。
中x= 。
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古巴彦淖尔市高三10月月考化学试卷(解析版) 题型:填空题
(21分)2012年8月24日,武汉市一家有色金属制造厂发生氨气泄露事故。已知在一定温度下,合成氨工业原料气H2制备涉及下面的两个反应:
C(s)+H2O(g) 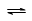 CO(g)+H2(g);
CO(g)+H2(g);
CO(g)+H2O(g)  H2(g)+CO2(g)。
H2(g)+CO2(g)。
(1)判断反应CO(g)+H2O(g)  CO2(g)+H2(g)达到化学平衡状态的依据是_____ ___。
CO2(g)+H2(g)达到化学平衡状态的依据是_____ ___。
A.容器内压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g)  2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
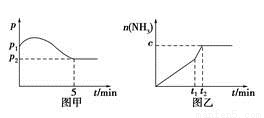
①若图中c=1.6 mol,则改变的条件是________(填字母);
②若图中c<1.6 mol,则改变的条件是_ __(填字母);此时该反应的平衡常数_____(填“增大”、“减小”、“不变”)
A.升温 B.降温 C.加压 D.减压 E.加催化剂
(3)如图甲,平衡时氢气的转化率为________。
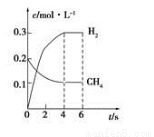
(4)工业上可利用如下反应:H2O (g)+CH4 (g)  CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如下图所示:0~4 s内,用H2 (g)表示的反应速率为____________,用CO(g)表示的反应速率为__________。
CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如下图所示:0~4 s内,用H2 (g)表示的反应速率为____________,用CO(g)表示的反应速率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com