
分析 (1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定离子浓度大小和溶液颜色变化;
(2)根据氧化还原反应中得失电子守恒来计算;
(3)根据溶度积常数以及水的离子积常数来进行计算;
(4)阳极是活性电极时,阳极本身失电子,生成阳离子;
(5)溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,氢氧根离子浓度增大,离子浓度幂的乘积大于溶度积,所以金属阳离子会生成氢氧化物沉淀.
解答 解:(1)c(H+)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
(2)根据电子得失守恒:n(Cr2O72-)×6=n(FeSO4•7H2O)×1,n(FeSO4•7H2O)=$\frac{1mol×6}{1}$=6mol,故答案为:6;
(3)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=$\root{3}{\frac{1{0}^{-32}}{1{0}^{-5}}}$=10-9 mol/L,c(H+)═$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,故答案为:5;
(4)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑,溶液酸性减弱;同时大量产生了OH-,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀;
故答案为:2H++2e-=H2↑,溶液酸性减弱;Fe(OH)3;
(5)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+,
故答案为:阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;
点评 本题主要考查了铬及其化合物的性质、氧化还原反应、沉淀溶解平衡和电化学知识等内容,难度中等,抓住题目信息是解题的关键.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
在一密闭容器中,反应 a A(g) b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,以下不正确的是( )
b B(g)+c C(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的70%,以下不正确的是( )
A.平衡向正反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数增加了
D.a<b+c
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列离子方程式正确的是
A.实验室用大理石和稀盐酸制取CO2:2H++CO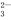 ===CO2↑+H2O
===CO2↑+H2O
B.氯气与水反应:Cl2+H2O===2H++Cl-+ClO-
C.氯化铝溶液加入氨水:Al3++3OH-===Al(OH)3↓
D.用氢氧化钠检验氯化铵溶液中铵根离子:NH +OH―
+OH― NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| C. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0 | |
| B. | 准确量取24.00 mL的液体可选用滴定管、量筒或滴定管 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | 在一密闭容器中发生2SO2(g)+O2(g)?2SO3(g)反应,增大压强,平衡会正向移动,$\frac{{c}^{2}({SO}_{3})}{{c}^{2}({SO}_{2})•c{(O}_{2})}$ 的值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 及时除去二氧化碳,正反应速率加快 | |
| B. | 其它条件不变,加入催化剂,△H变大 | |
| C. | 增大压强,正反应速率增大,逆反应速率减小 | |
| D. | 降低温度,可提高反应物的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、O2完全转化为SO3 | B. | SO2、O2、SO3的浓度均不再变化 | ||
| C. | SO2、O2、SO3的浓度一定相等 | D. | 正、逆反应速率相等且等于零 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
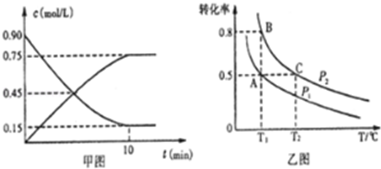
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com