
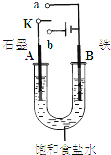
��12�֣�ij����С��ͬѧ����ͼװ�ý���ʵ�飬�Իش��������⡣

��1������ʼʱ����K��a���ӣ���A���ĵ缫��Ӧʽ
Ϊ ��
��2������ʼʱ����K��b���ӣ����ܷ�Ӧ�����ӷ���ʽΪ ��
�й�����ʵ�飬����˵����ȷ���ǣ�����ţ� ��
����Һ��Na+��A���ƶ�
�ڴ�A�����ݳ���������ʹʪ��KI������ֽ����
�۷�Ӧһ��ʱ�����NaCl����������������ɻָ������ǰ����ʵ�Ũ��
������״����B������2.24 L���壬����0.2 mol����ת��
��3����С��ͬѧģ�ҵ�������ӽ���Ĥ�����ռ�ķ�������ô��������������ͼװ�õ���������Һ����ȡ������������������������ء�

�ٸõ��۵�������ӦʽΪ ����ʱͨ�������ӽ���Ĥ��������
������ڡ���С�ڡ����ڡ���ͨ�������ӽ���Ĥ����������
���Ƶõ�����������Һ�ӳ��ڣ���д��A���� ��D���� ������
�������Ƶõ�����������������������Һ���Ϊ����ȼ�ϵ�أ����ظ����ĵ缫��ӦʽΪ ��
��1��2H2O + O2��4e����4OH- ��2�֣�
��2��2Cl- + 2H2O ��� 2OH- + H2�� + Cl2����2�֣� �ڢܣ�2�֣�
��3���� 4OH- - 4e- = 2H2O + O2����2�֣� �� С�ڣ�1�֣�
��D(1��) ��H2 +2OH- - 2e- = 2H2O��2�֣�
������������ԭ��ء����ص�ԭ�����жϼ���Ӧ�á�
��1��K��a������ԭ��أ����ý����������������Ǹ�����ʯī�����������������������ʴ��������ӦʽΪ2H2O + O2��4e����4OH-��
��2������K��b���ӣ��ɵ��أ���ⱥ��ʳ��ˮ��ʯī�͵�Դ�����������������������ӷŵ��������������͵�Դ�����������������������ӷ����������������ܷ�ӦʽΪ2Cl- + 2H2O ��� 2OH- + H2�� + Cl2���������������������������ƶ����ٲ���ȷ��A���õ����������������⻯�����ɵ��ʵ⣬������������ɫ������ȷ�������ܷ�Ӧʽ��֪������Һ�зų���������������������Ҫ�ָ�ԭ״̬����Ҫͨ���Ȼ������壬�۲���ȷ��B��������2.24 L�������������ڱ�״������0.1mol������2H����2e��=H2��֪��ת��0.2mol���ӣ�����ȷ��
��3������װ��ͼ���жϣ�A�͵�Դ��������������������Һ�е�OH-�ŵ������������缫��ӦʽΪ4OH- - 4e- = 2H2O + O2����D�͵�Դ�ĸ�������������������Һ�е������ӷŵ磬�����������缫��ӦʽΪ4H����4e��=2H2����ʱͨ�������ӽ���Ĥ��������SO42�����������ӽ���Ĥ��������K��,���ݵ���غ��֪����������ĿС����������Ŀ��������������D�ŵ磬��������������D�����ɡ���ȼ�ϵ��������ͨ�븺�������Ե缫��ӦʽΪH2 +2OH- - 2e- = 2H2O��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij����С��ͬѧ����ͼװ�ý���ʵ�飬�Իش��������⣮
ij����С��ͬѧ����ͼװ�ý���ʵ�飬�Իش��������⣮
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2008?��ݸģ�⣩ij����С��ͬѧ����ͼװ�ý���ʵ�飬�Իش��������⣮
��2008?��ݸģ�⣩ij����С��ͬѧ����ͼװ�ý���ʵ�飬�Իش��������⣮
| ||
| ||
 ����������������������أ�
����������������������أ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij����С��ͬѧ����ͼװ�ý���ʵ�飬һ��ʱ�����C�缫������ͭ�������Իش��������⣮
ij����С��ͬѧ����ͼװ�ý���ʵ�飬һ��ʱ�����C�缫������ͭ�������Իش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij����С��ͬѧ����ͼװ�ý���ʵ�飬�Իش��������⣺
ij����С��ͬѧ����ͼװ�ý���ʵ�飬�Իش��������⣺
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij����С��ͬѧ����ͼװ�ý���ʵ�飬�Իش��������⣮
ij����С��ͬѧ����ͼװ�ý���ʵ�飬�Իش��������⣮�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com