
【题目】某烃结构简式为(![]() -C≡C-CH=CH-CH3,有关其结构的说法正确的是
-C≡C-CH=CH-CH3,有关其结构的说法正确的是
A. 所有碳原子可能在同一平面上 B. 所有碳原子可能在同一条直线上
C. 最多有18个原子在同一平面上 D. 最多有7个原子在同一直线上
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】t℃时,将 2molSO2 和 1molO2 通入体积为 2L 的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成 SO3 的平均反应速率为__________ ;平衡时,SO2 转化率为_____________
(2)下列叙述能证明该反应已达到化学平衡状态的是 __________
A.容器内压强不再发生变化 B.SO2 的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗 2nmolSO2 的同时消耗 nmolO2
E.相同时间内消耗 2nmolSO2 的同时生成 nmolO2 F.混合气体密度不再变化
(3)以下操作会引起化学反应速率变快的是__________
A.向容器中通入O2 B.扩大容器的体积 C.使用正催化剂
D.升高温度 E.向容器中通入氦气。
(4)t2℃时,若将物质的量之比 n(SO2) :n(O2)=1:1 的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了 20%。则SO2 的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种固体物质溶解度曲线如图所示。请回答:
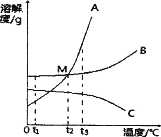
(1)图中M点表示_________________;
(2)t3℃时A、B、C三种物质的溶解度由小到大的顺序是____________;
(3)现有t1℃时A、B、C的三种饱和溶液,分别将它们升温到t3℃,溶质的质量分数由大到小的顺序是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol某烃在氧气中充分燃烧,需要消耗氧气179.2L(标准状况),它在光照条件下与氯气反应能生成3种不同的一氯代物。则该烃的结构简式是
A. 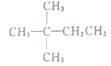 B. CH3CH2CH2CH2CH3
B. CH3CH2CH2CH2CH3
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 常温常压下,48g O3含有的氧原子数为3NA
B. 标准状况下,22.4L Cl2与足量的Fe反应转移的电子数为3NA
C. 已知可逆反应:2NO2![]() N2O4,将2molNO2放入反应容器中,生成的N2O4的物质的量一定是1mol
N2O4,将2molNO2放入反应容器中,生成的N2O4的物质的量一定是1mol
D. 58.5gNaCl固体溶于1L的水中,所得溶液的物质的量浓度为1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。消除汽车尾气中的NO、CO,有利于减少PM2.5 的排放。已知如下信息:
①2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H1=- 748kJ/mol
2CO2(g)+N2(g) △H1=- 748kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-565kJ/mol
(1)在一定条件下N2和O2会转化为NO,写出该反应的热化学方程式:______________。
(2)为研究不同条件对反应的影响,在恒温条件下,向2L 恒容密闭容器中加入0.2moINO 和0.3moICO,在催化剂存在的条件下发生反应①,10min 时反应达到平衡,测得10min 内v(NO)=7.5×10-3mol/(Lmin),则平衡后CO 的转化率为_______________。
(3)其他条件相同,t min 时不同温度下测得NO 的转化率如图( I)所示。A 点的反应速率v正___(填“>”、“<”或“=”)v逆,A、B两点反应的平衡常数较大的是_______(填“A”或“B”),理由是__________________。
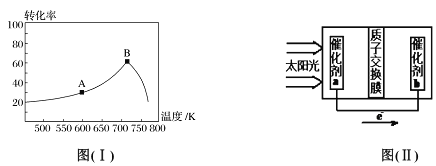
(4)已知常温下: Ka(HNO2)=7.1×10-4mol/L;Kb(NH3·H2O)=1.7×10-5mol/L。0.1mol/LNH4NO2溶液中离子浓度由大到小的顺序是_________,常温下NO2-水解反应的平衡常数K=____。
(5)人工光合作用能够借助太阳能用CO2和水制备化学原料,图(II )是通过人工光合作用制备HCOOH 的原理示意图,请写出催化剂b处的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ka 为平衡常数,pKa=﹣lgKa,25℃时,H2A的 pKa1 =1.85,pKa2=7.19。用 0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如下图所示(曲线上的数字为 pH)。下列说法不正确的是

A.a 点所得溶液中;2c(H2A)+c(A2-)=0.002mol
B.b 点所得溶液中:c(H2 A)+c(H+)=c(A2-)+C(OH-)
C.C 点所得溶液中:c(Na+)<3c(HA-)
D.d 点所得溶液中:c(Na+)>c(A2-)>c(HA-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com