


科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于两支试管中 | ′ |
| 步骤2: | 若有 |
| 步骤3: | 若有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物的化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z元素的最外层电子数与电子层数相同 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
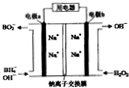 以NaBH4(B元素的化合价为+3)和H2O2为原料的电池,可以作为空军通讯卫星的高能电池.其电极负材料为Pt/C,正极材料为MnO2,其工作原理如图所示,下列说法不正确的是( )
以NaBH4(B元素的化合价为+3)和H2O2为原料的电池,可以作为空军通讯卫星的高能电池.其电极负材料为Pt/C,正极材料为MnO2,其工作原理如图所示,下列说法不正确的是( )| A、该电池工作时Na+由a极区移向b极区 |
| B、正极材料采用MnO2,MnO2既做电极材料又有催化作用 |
| C、该电池的负极反应为:BH4-+8OH--8e-→BO2-+6H2O |
| D、电路中通过6.02×1022个电子时,理论上消耗H2O2 0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
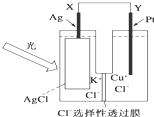 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:W>Z>Y>X |
| B、Y元素在周期表中的位置为第三周期第ⅣA族 |
| C、1mol甲与足量的乙完全反应共转移了1mol电子 |
| D、1.0L0.1mol?L-1戊溶液中阴离子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24L氨气中氨分子数目为0.2NA |
| B、1mol甲基中电子数目为9NA |
| C、1L0.1mol?L-1NaHCO3溶液中氧原子数目为0.3NA |
| D、7.8gNa2O2与足量H2O反应,转移电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com