
已知在浓H2SO4存在并加热至170℃的过程中,2个乙醇分子在羟基上可发生分子间脱水反应生成 醚,
醚, 如 CH3CH2—OH+HO—CH2CH3
如 CH3CH2—OH+HO—CH2CH3 CH3CH2—O—CH2CH2+H2O。用浓 H2SO4跟分子式分别为CH4O和C3H8O的醇的混合液在一定条件下脱水,可得到的有机物的种类有
CH3CH2—O—CH2CH2+H2O。用浓 H2SO4跟分子式分别为CH4O和C3H8O的醇的混合液在一定条件下脱水,可得到的有机物的种类有
A.5种 B.6种 C.7种 D.8种
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源:2015-2016学年浙江省宁波市高一下学期选考期中化学试卷(解析版) 题型:选择题
下列事实不能作为实验判断依据的是
A、钠和镁分别与冷水反应,判断钠和镁的金属活动性强弱
B、在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属活动性强弱
C、硫酸和硅酸钠溶液反应出白色沉淀,判断硫与硅的非金属活动性强弱
D、Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期中考试化学试卷(解析版) 题型:推断题
已知A、B、C、D、E五种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,C与A同主族;A与B、D、E所形成的常见化合物在常温下均呈气态,在周期表中D与E左右相邻,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数与E的最外层电子数相同。请回答下列问题:
(1)C的离子结构示意图是 。
(2)A、B、E可组成一种化合物,其原子个数之比为4:1:1,该化合物中存在的化学键类型 。
(3)D2E2分子的结构式为 ;C与D同主族短周期元素原子形成个数比为1:1的化合物,其电子 式 。
(4) BE3在常温下是一种淡黄色的液体,遇水即发生水解可生成一种具有漂白性的物质和一种有刺激性气味气体,写出该反应的方程式 ;
(5)下列事实能证明D与E非金属性强弱的是 (选填字母序号)。
A.常温下,D的单质呈固态,E的单质呈气态
B.E的氢化物的稳定性强于D的氢化物
C.E与D形成的化合物中,D呈正价
D.E的氢化物的沸点高于D的氢化物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期中考试化学试卷(解析版) 题型:选择题
下列关于反应能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1 ,则反应物总能量大于生成物总能量
B.若一定条件下,A=B ΔH<0,说明A物质比B物质稳定
C.101 kPa时,2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1 ,则H2的燃烧热为571.6 kJ·mol-1
D.H+ (aq)+OH- (aq)=H2O(l) ΔH=-57.3 kJ·mol-1 ,含1 mol NaOH的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量.
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三三诊理综化学试卷(解析版) 题型:填空题
高锰酸钾是中学化学常用的试剂。工业上用软锰矿制备高锰酸钾流程如下:
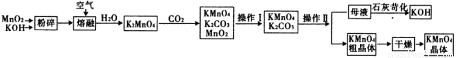
(1)铋酸钠(NaB iO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+),Mn2+的氧化产物为MnO4-,写出反应的离子方程式_________________________________________。
iO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+),Mn2+的氧化产物为MnO4-,写出反应的离子方程式_________________________________________。
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_____(填代号)。
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
(3)上述流程中可以循环使用的物质有氢氧化钾和_______(写化学式)。
(4)理论上(若不考虑物质循环与制备过程中的损失)1 mol MnO2可制得_____mol KMnO4。
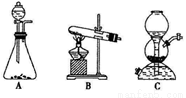
(5)该生产中需要纯净的CO2气体。写出实验室制取CO2的化学方程式___________________,所需气体发生装置可以是______(选填代号)。
(6)操作Ⅰ的名称是________;操作Ⅱ根据 KMnO4和K2CO3两物质在______(填性质)上的差异,
采用__________(填操作步骤)、趁热过滤得到 KMnO4。
查看答案和解析>>
科目:高中化学 来源:2016届云南省高三下第七次月考理综化学试卷(解析版) 题型:填空题
高纯六水氯化锶晶体(SrCl2•6H2O)具有很高的经济价值,工业上用w kg难溶于水的的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),共制备高纯六水氯化锶晶体(a kg)的过程为:
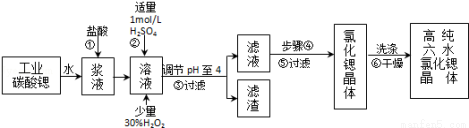
已知:Ⅰ.SrCl2•6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:

(1)操作①加快反应速率的措施有________________ (写一种)。操作①中盐酸能否改用硫酸,其理由是:
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为________.
(3)在步骤②﹣③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为________.
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是________ (填化学式).
(5)工业上完成操作③常用的设备有:
A分馏塔 B 离心机 C 热交换器 D 反应釜
(6)工业上用热风吹干六水氯化锶,适宜的温度是____________
A.40~50℃ B.50~60℃ C.60~70℃ D.80℃以上.
(7)已知工业流程中锶的利用率为90%根据以上数据计算工业碳酸锶的纯度:
查看答案和解析>>
科目:高中化学 来源:2016届云南省高三下第七次月考理综化学试卷(解析版) 题型:选择题
邻甲基苯甲酸有多种同分异构体,其中属于酯类且分子结构中有—CH3和苯环的同分异构体有
A.6种 B.5种 C.4种 D.3种
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:填空题
重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶。Cr2O72-+3C2H5OH+16H+=4[Cr(H2O)6]3++3CH3COOH
(1)铬原子核外有______个未成对电子。1mol[Cr(H2O)6]3+中含有δ键的数目是______。
(2)CH3COOH中C原子轨道杂化类型为_________。
(3)CH3CH2OH与H2O可以任意比互溶,是因为_________。
(4)C、O位于周期表中第二周期,请比较两者第一电离大小:C_____O(填“>”或“<”)
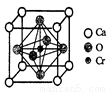
(5)Cr和Ca可以形成一种具有特殊导电性的复合氧化物,晶胞如图所示。该晶体的化学式为__________。
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:选择题
正确使用化学用语是学好化学的基础。以下化学用语的使用中不正确的是( )
A.酒精的实验式为:C2H6O
B.原子核中有7个中子的碳原子:136C
C.铝离子的电子式:Al3+
D.二氧化硅的结构式O=Si=O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com