
【题目】金属冶炼中不会涉及的反应类型是( )
A.氧化还原反应B.置换反应
C.热分解反应D.复分解反应
【答案】D
【解析】
金属冶炼是工业上将金属从含有金属元素的矿石中还原出来的生产过程,金属的活动性不同,可以采用不同的冶炼方法.总的说来,金属的性质越稳定,越容易将其从化合物中还原出来.金属冶炼的方法主要有:
热分解法:对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来,例如:2HgO ![]() 2Hg+O2↑,属于分解反应,也是氧化还原反应;
2Hg+O2↑,属于分解反应,也是氧化还原反应;
热还原法:在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来,例如:Fe2O3+3CO ![]() 2Fe+CO2↑,属于氧化还原反应;
2Fe+CO2↑,属于氧化还原反应;
电解法:活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属,例如:2Al2O3 ![]() 4Al+3O2↑,属于分解反应,也是氧化还原反应;
4Al+3O2↑,属于分解反应,也是氧化还原反应;
置换法:活泼金属把较不活泼金属从其盐中置换出来,例如:Fe+CuSO4=Cu+FeSO4,属于置换反应,也是氧化还原反应。
综上,没有涉及复分解反应。
答案选D。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,能潮解,难溶于水,可与水缓慢反应,不溶于乙醇,易与酸反应,常用作杀菌剂、防腐剂等。根据题意,回答相关问题。
I.CaO2晶体的制备:
CaO2晶体通常可利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图如下:

(1)三颈烧瓶中发生的主要反应的化学方程式为_____。
(2)冷水浴的目的是____;步骤③中洗涤CaO2·8H2O的实验操作方法是______
Ⅱ.CaO2含量的测定:
测定CaO2样品纯度的方法是:称取0.200g样品于锥形瓶中,加入50mL水和15mL2mol·L-lHCl,振荡使样品溶解生成过氧化氢,再加入几滴MnCl2稀溶液,立即用0.0200mol·L-lKMnO4标准溶液滴定到终点,消耗25.00mL标准液。
(3)上述过程中使用稀盐酸而不使用稀硫酸溶解样品的原因是___ ;滴定前加入MnCl2稀溶液的作用可能是____。
(4)滴定过程中的离子方程式为_______,样品中CaO2的质量分数为______ 。
(5)实验I制得的晶体样品中CaO2含量偏低的可能原因是:①____;② ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气有毒,且大量制取的难度较大、污染严重,在培养皿中研究氯气的性质可实现“绿色实验”。在培养皿的点滴板中央孔穴中滴加能生成氯气的试剂(如漂粉精与盐酸),然后分别滴加所要进行实验的试剂,如下图。下列是某学生观察到的现象、解释与结论,其中不符合事实的是( )
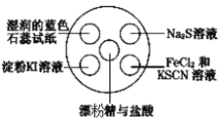
选项 | 实验现象 | 解释 | 结论 |
A | 淀粉 | 氯气置换出 | 氧化性: |
B |
| 氯气置换出 | 非金属性: |
C | 湿润的蓝色石蕊试纸先变红后褪色 | 氯气与水反应生成盐酸和次氯酸 | 氯气具有漂白性 |
D |
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是( )
A. 4 L、0.5 mol·L-1NaCl溶液 B. 1 L、0.3 mol·L-1Na2SO4溶液
C. 5 L、0.4 mol·L-1NaOH溶液 D. 2 L、0.15 mol·L-1、Na3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述不正确的是
A. 常温常压下,1 mol氦气中含有的质子数为2NA
B. l0g46%乙醇水溶液中所含氧原子数为0.4NA
C. 1 Ll mol/LNa2CO3溶液中,阴离子总数小于NA
D. 浓硝酸热分解生成NO2、N2O4共23g,转移电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(分子式为:C2H4)是来自石油的重要有机化工原料,B、D是厨房中的两种有机物,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
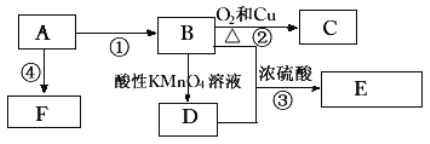
(1)A的电子式为________,官能团为:________;C的名称________,E的分子式为:________。
(2)B分子中的官能团名称是________,D分子中的官能团名称是________.
(3)写出下列反应的化学方程式并指出反应类型:
①________,反应类型________。
②________,反应类型________。
④________,反应类型________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萝卜硫素(结构如图)是具有抗癌和美容效果的天然产物之一,在一些十字花科植物中含量较丰富。该物质由五种短周期元素构成,其中W、X、Y、Z的原子序数依次增大,Y、Z原子核外最外层电子数相等。下列叙述一定正确的是( )
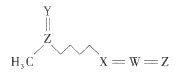
A.原子半径的大小顺序为Z>W>X>Y
B.X的简单氢化物与W的氢化物反应生成离子化合物
C.萝卜硫素中的各元素原子最外层均满足8电子稳定结构
D.Y、Z形成的二元化合物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应过程中的先后顺序,下列评价正确的是
A.向浓度都为0.1mol/L的FeCl3和CuCl2加入铁粉,溶质CuCl2首先与铁粉反应
B.向过量的Ba(OH)2溶液中滴加少量的KAl(SO4)2溶液,开始没有白色沉淀生成
C.向浓度都为0.1mol/L 的Na2CO3和NaOH的混合溶液通入CO2气体,NaOH首先反应
D.向浓度为0.1mol/L的FeCl3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com