
| A. | K+、NO3ˉ、HCO3ˉ、Clˉ | B. | SO42-、Mg2+、Clˉ、Na+ | ||
| C. | SO42-、Na+、Mg2+、CH3COOˉ | D. | Clˉ、AlO2ˉ、K+、NH4+ |
科目:高中化学 来源: 题型:选择题
| A. | +16.3 | B. | -16.3 | C. | +335.7 | D. | -335.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

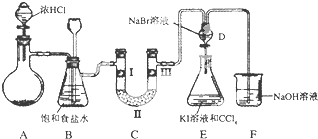
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上F单质用MnO2和AF来制备 | |
| B. | B元素所形成的单质的晶体类型都是相同的 | |
| C. | F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B | |
| D. | 由化学键角度推断,能形成BDF2这种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于硫酸氢钠溶液中:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | Mg(HCO3)2溶液与过量的NaOH溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O | |
| C. | FeI2溶液中通入过量Cl2:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- | |
| D. | 从酸化的海带灰浸出液中提取碘:2H++2I-+H2O2═I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
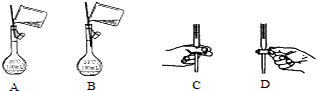
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 澄清的石灰水与稀盐酸反应:OH-+H+═H2O | |
| C. | 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-═AgCl↓+NO3- | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、NO3-、SO42- | B. | K+、H+、SO42-、OH- | ||
| C. | Al3+、NH4+、OH-、Cl- | D. | Ca2+、Na+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有$S{O}_{4}^{2-}$ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,一定有$C{O}_{3}^{2-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com