
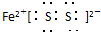
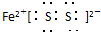
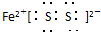 ,
,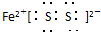 ;
;| 8×106.5 |
| 0.25 |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
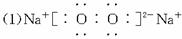
(1)写出化合物B的电子式_____________________。
(2)反应④的离子方程式为_____________________。
反应⑤的化学方程式为___________________________________________________。
(3)已知每生成16 g E,放出106.5 kJ的热量,则反应①的热化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
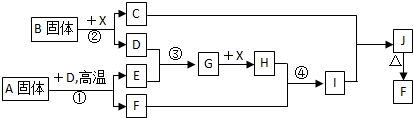
根据下列框图关系填空,已知反应①、③是工业生产中的重要反应,D、E常温下为气体、X常温下为无色液体,H与E相对分子质量之间的关系为:Mr(H) -Mr(E) =34,又知C焰色反应火焰呈黄色。
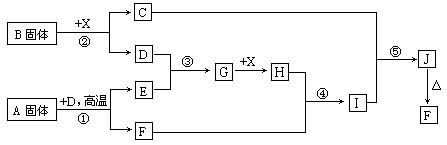
(1) 反应②的化学方程式:__________________________________;
产物C的电子式:_______________________。
(1)化合物A中所包含的化学键有:_______________________。
(2)反应④的离子方程式:_______________________________。
反应⑤的化学方程式:__________________________________。
(3)已知每生成16g E,放出106.5 kJ热量,则反应①的热化学方程式为:
_________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)根据下列框图关系填空。已知常温下X为无色液体,D、E均为无色气体,
G是一种重要的工业产品。C的焰色反应为黄色,E、F的相对分子量之间的关系为
M(F)=M(E)+16。回答下列问题:
(1)A中化学键的类型为 ,写出B的一个用途 。
(2)将固体A加入FeCl3溶液中的主要现象是 。
(3)写出气体B的水溶液与CuSO4溶液反应的离子方程式 。
(4)写出反应②的化学方程式 。
(5)经测定,反应④中每生成1.0gX,放出3.2KJ的热量(常温下)。试写出反应④
的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013届江西省吉安市高三上学期周测化学试卷(解析版) 题型:填空题
(12分)根据下列框图关系填空。已知反应①、③是工业生产中的重要反应,D、E常温下为气体、X常温下为五色液体,H与E相对分子质量之间的关系为:Mr(H)-Mr(E)=34,又知C的焰色反应呈黄色。
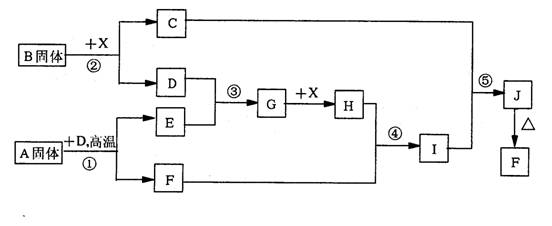
(1)化合物B中所包含的化学键有___________________
(2)反应④的离子方程式:________________________________
反应⑤的化学方程式:________________________________
(3)已知每生成16gE,放出106.5kJ热量,则反应①的热化学方程式为:
______________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com