
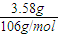 =0.0338mol,消耗盐酸体积为
=0.0338mol,消耗盐酸体积为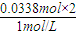 =0.0676l=67.6mL<80mL,故盐酸过量;
=0.0676l=67.6mL<80mL,故盐酸过量;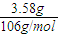 =0.0338mol,消耗盐酸体积为
=0.0338mol,消耗盐酸体积为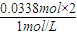 =0.0676l=67.6mL<80mL,故盐酸过量;
=0.0676l=67.6mL<80mL,故盐酸过量;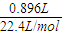 =0.04mol,令Na2CO3和NaHCO3的物质的量分别为xmol、ymol,则:
=0.04mol,令Na2CO3和NaHCO3的物质的量分别为xmol、ymol,则: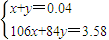 ,解得x=0.01,y=0.03,
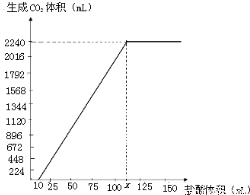
,解得x=0.01,y=0.03,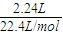 =0.1mol,根据NaHCO3+HCl═NaCl+CO2↑+H2O可知消耗HCl为0.1mol,该阶段消耗盐酸的体积为
=0.1mol,根据NaHCO3+HCl═NaCl+CO2↑+H2O可知消耗HCl为0.1mol,该阶段消耗盐酸的体积为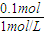 =0.1L=100mL,故x=10mL+100mL=110mL,
=0.1L=100mL,故x=10mL+100mL=110mL,

 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源:四川省广元中学2010届高三第四次月考、化学试卷 题型:058
我国著名化学家侯德榜先生发明的“侯氏制碱法”,因原料利用率高,并能进行连续生产,从而享誉中内外.“侯氏制碱法”的基本做法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱.它的反应原理可用下列化学方程式表示:
NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NaHCO3Na2![]() CO3+CO2+H2O
CO3+CO2+H2O
某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如下一套实验装置

实验室可选药品有浓氨水、纯碱、大理石、稀盐酸、稀硫酸、熟石灰、氯化铵、氯化钠
(1)选用最合适的试剂的名称D________
(2)本实验具体操作过程中,应先通________气体,再通________气体;
(3)指出该装置的三处错误________ ________ ________
(4)在改进装置后,该同学进行了实验,实验所用的饱和NaCl溶液中含溶质58.5 g,实验最后得到无水碳酸钠26 g,则其产率为________;该同学针对其实验结果,认真分析了造成损失的原因,发现其操作步骤并没有错误,则主要原因是________
(5)在“侯氏制碱法”的工业生产中,原料的利用率高,大大降低了成本.请问本实验中哪些物质可重复利用?________
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题
 Na2CO3+CO2↑+H2O。某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如图所示的一套实验装置:
Na2CO3+CO2↑+H2O。某课外兴趣小组同学,按照“侯氏制碱法”原理,设计了如图所示的一套实验装置: 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com