
| A. | 乙烯的结构简式为:CH2=CH2 | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 醋酸的分子式:CH3COOH | |
| D. | 乙醇的结构式为: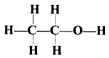 |
分析 A、乙烯的结构简式中碳碳双键不能省略;
B、质量数=质子数+中子数;
C、表示物质的元素组成的式子为分子式;
D、用一条短线代表一对共用电子对所得到的式子为结构式.
解答 解:A、乙烯的结构简式中碳碳双键不能省略,故乙烯的结构简式为CH2=CH2,故A正确;
B、质量数=质子数+中子数,故中子数为10的氧原子的质量数为10+8=18,符号为188O,故B正确;
C、表示物质的元素组成的式子为分子式,故醋酸的分子式为C2H4O2,故C错误;
D、用一条短线代表一对共用电子对所得到的式子为结构式,故乙醇的结构式为 ,故D正确.
,故D正确.
故选C.
点评 本题考查了常见的化学用语,难度不大,应注意的是分子式、结构简式、结构式和电子式等书写方法的区别.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铁的质量为5.4 g | |
| B. | 合金与稀硫酸反应共生成0.45 mol H2 | |
| C. | 该合金与足量氢氧化钠溶液反应,转移的电子数为0.3NA | |
| D. | 所加的稀硫酸中含0.6 mol H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)若向Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,试从平衡的角度解释沉淀转化的原因:氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,最有氢氧化镁全部转化为红褐色的氢氧化铁沉淀
(1)若向Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,试从平衡的角度解释沉淀转化的原因:氢氧化镁浊液中存在沉淀溶解平衡:Mg(OH)2?Mg2++2OH-,由于KSP[Fe(OH)3]<KSP[Mg(OH)2],所以当加入Fe3+后,会和OH-反应生成更难溶的氢氧化铁沉淀,使得上述平衡正向移动,最有氢氧化镁全部转化为红褐色的氢氧化铁沉淀查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2mol/(L•min) | B. | 1mol/(L•min) | C. | 0.6mol/(L•min) | D. | 0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的转化率变大 | B. | a<c+d | ||
| C. | A的质量分数变小 | D. | 平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com