
 CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.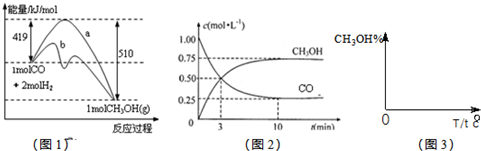
 CH3OH(g)的平衡常数为
CH3OH(g)的平衡常数为 CH3OH(g)△H=419KJ/mol-510KJ/mol═-91kJ?mol-1,故a错误;
CH3OH(g)△H=419KJ/mol-510KJ/mol═-91kJ?mol-1,故a错误;| 0.75mol/L |
| 10min |
 CH3OH(g)
CH3OH(g)| 0.75mol/L |
| 0.25mol/L×(0.5mol/L )2 |
 CH3OH(g)△H<0,
CH3OH(g)△H<0, ,故答案为:
,故答案为: .
.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com