
【题目】已知硅在自然界中有3种同位素: ![]() 、
、 ![]() Si、
Si、 ![]() .硅的近似相对原子质量为28.1,则
.硅的近似相对原子质量为28.1,则 ![]() 原子在自然界中的百分含量为( )
原子在自然界中的百分含量为( )
A.等于90%
B.大于90%
C.小于90%
D.无法判断
科目:高中化学 来源: 题型:
【题目】铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护拦等。下列性质中与这些用途无关的是
A. 不易生绣 B. 导电性好 C. 密度小 D. 强度高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知向FeCl2溶液中滴加稀硝酸,溶液颜色由浅绿色变为棕黄色.某同学用此反应设计了如图所示原电池. 
(1)写出FeCl2与稀硝酸反应的离子方程式 .
(2)图中电子流动方向为极到极.
(3)在乙烧杯中会观察到的现象为 , 写出乙烧杯中的电极反应方程式 .
(4)H+流向烧杯,若一段时间内流向该烧杯的H+有0.05mol,则消耗Fe2+g
(5)该装置存在的缺点可能是(写一点)
(6)若将乙烧杯的稀硝酸换成浓硝酸,写出a电极上的电极反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学模拟工业制碘的方法,探究ClO3﹣和I﹣的反应规律.实验操作及现象如表:
实验及试剂 | 编号 | 无色NaClO3 | 试管中 | 淀粉KI |
| 1 | 0.05 mL | 浅黄色 | 无色 |
2 | 0.20 mL | 深黄色 | 无色 | |
3 | 0.25 mL | 浅黄色 | 蓝色 | |
4 | 0.30 mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如图实验: 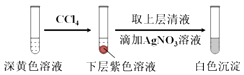
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3﹣和I﹣发生反应的离子方程式: .
(2)查阅资料:一定条件下,I﹣和I2都可以被氧化成IO3﹣ .
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2 .
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3﹣ . 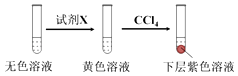
其中试剂X可以是(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2 , 便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33molL﹣1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是 , 进一步佐证实验4中生成了Cl2 . 获得结论:NaClO3溶液用量增加导致溶液褪色的原因是(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
编号 | 6.0 molL﹣1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25 mL | 浅黄色 | 无色 |
6 | 0.85 mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是 .
②用离子方程式解释实验6的现象: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜可以发生如下两个反应:
1)2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4
2)11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是( )
A.上述两个反应中,水既不是氧化剂也不是还原剂
B.上述两个反应中,氧化产物都是H3PO4
C.反应(2)中,1mol CuSO4可氧化1/5molP
D.上述两个反应中,氧化剂都只有硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,X,Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液.通电一段时间后,发现d电极上覆盖一层红色物质.
根据以上实验事实,回答下列问题:
(1)c极的电极反应式为;
(2)A槽中发生反应的离子方程式为;
(3)A槽中溶液的pH(填“变大”、“变小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下: ①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.请回答:
(1)如图所示,仪器A的名称是; 
(2)NaOH溶液稍过量的原因 .
(3)加入NaOH溶液的正确操作是(填字母).
A.沿玻璃棒缓慢加入
B.一次迅速加入
C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是 .
(5)设溶液的密度均为1gcm﹣3 , 中和后溶液的比热容c=4.18J(g℃)﹣1 , 请根据实验数据写出该中和热的热化学方程式
温度 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 25.0 | 25.2 | 28.5 | ||
2 | 24.9 | 25.1 | 28.3 | ||
3 | 25.5 | 26.5 | 31.8 | ||
4 | 25.6 | 25.4 | 29.0 | ||
(6)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)怎样才能确保读取混合液的最高温度? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图铜锌原电池示意图,回答下列问题: 
(1)该原电池总离子反应式是
(2)外电路电流的方向是从(填Zn到Cu或Cu到Zn).
(3)在电池的工作过程中,Zn极质量变化了3.25g,则Cu极质量 (填“增加”、“不变”或“减少”),电路中转移电子为mol,铜表面析出了氢气L(标准状况下).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com