
(11分)已知:I2+2 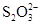 ===
=== 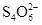 +2I-。相关物质的溶度积常数见下表:
+2I-。相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)Cu(OH)2或Cu2(OH)2CO3 2.6×10-9 mol·L-1
(2)2CuCl2·2H2O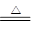 Cu(OH)2·CuCl2+2HCl↑+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可] 在干燥的HCl气流中加热脱水
Cu(OH)2·CuCl2+2HCl↑+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可] 在干燥的HCl气流中加热脱水
(3)①淀粉溶液 蓝色褪去,放置一定时间后不复色
②2Cu2++4I-=2CuI↓+I2 ③95%
解析试题分析:
(1)除去Cu2+中的Fe3+的原理是利用Fe3+水解生成Fe(OH)3和H+,向其中加入氧化铜或氢氧化铜或碳酸铜或碱式碳酸铜中和H+,使水解平衡向右移动,形成氢氧化铁沉淀。Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-),由pH=4得c(OH-)=10-10mol/L,c(Fe3+)=2.6×10-9 mol·L-1。
(2)氯化铜晶体受热分解生成氯化铜和水,氯化铜水解生成氢氧化铜,盐酸挥发,所以加热氯化铜晶体得到氢氧化铜甚至温度过高得到氧化铜或它们的混合物。2CuCl2·2H2OCu(OH)2·CuCl2+2HCl↑+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可];由氯化铜制无水氯化铜的方法是在氯化氢气氛中加热以抑制氯化铜水解。
(3)用硫代硫酸钠滴定I2可用淀粉溶液作指示剂,终点现象是溶液由蓝色变无色且30s不变色。
氯化铜溶液与碘化钾溶液反应离子方程式为:2Cu2++4I-===2CuI↓+I2。
设CuCl2·2H2O物质的量为xmol:
2CuCl2·2H2O~I2~2S2O32-
2 2
x 0.1×0.02mol
x=0.002mol
CuCl2·2H2O质量分数为95%。
考点:盐类水解的应用 溶度积 化学实验 化学计算
点评:多步反应计算学会找出关系式。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 25±15mg/kg |
| 储存方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
2- 3 |
2- 6 |
| 4.2×102 |
| w |
| 4.2×102 |
| w |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| O | - 2 |
| O | - 2 |
| O | 2- 6 |
| 90.5cV |
| 4m |
| 90.5cV |
| 4m |
查看答案和解析>>
科目:高中化学 来源:2014届河南安阳一中高二奥赛班第二次阶段考试化学试卷(解析版) 题型:填空题
(11分)已知:I2+2 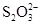 ===
===  +2I-。相关物质的溶度积常数见下表:
+2I-。相关物质的溶度积常数见下表:
|
物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
|
Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是__________________________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是__________________________________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是________________________。
②CuCl2溶液与KI反应的离子方程式为___________________________。
③该试样中CuCl2·2H2O的质量百分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
]已知:I2+2![]() =
=![]() +2I-。相关物质的溶度积常数见下表:
+2I-。相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________。
过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体。
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是___________________(用化学方程式表示)。由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是___________。
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用___________作滴定指示剂,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为______________________________。
③该试样中CuCl2•2H2O的质量百分数为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com