


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| B、过量的SO2通入澄清石灰水中:Ca2++2OH-+SO2=CaSO3↓+H2O |
| C、盐酸与硅酸钠溶液混合:2H++SiO32-=H2SiO3↓ |
| D、硫酸铝溶液中加入到过量的烧碱中:Al3++3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
| 3 |
| 2 |
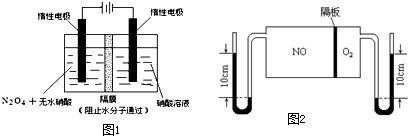
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮的单质和化合物在工农业生产中有着广泛的应用.
氮的单质和化合物在工农业生产中有着广泛的应用.
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映元素的原子结构和元素的性质.如图是元素周期表的一部分.请用元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:
 12.硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
12.硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
||||||||
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com