
标准状况下,将4.48 L的NO2和N2组成的混合气体通入以100 mL的水中,气体体积缩小为2.24 L,假设溶液的体积不变,则下列说法中不正确的是
A.所得溶液中溶质的物质的量浓度为1.0 mol·L-1 B.反应过程中转移的电子总数为0.1 mol
C.原混合气体中NO2和NO的体积比为1∶1 D.剩余气体中氮元素与氧元素的质量为7∶8
CD
【解析】NO2溶于水的方程式为3NO2+H2O=2HNO3+NO,即每消耗3mol气体,气体体积就减小2mol。实际体积减小4.48L-2.24L=2.24L,物质的量是0.1mol,所以参加反应的NO2是0.15mol,则氮气是0.05mol。根据方程式可知,每消耗3molNO2,就是生成2mol硝酸,转移2mol电子。所以实际转移电子是0.1mol,生成硝酸也是0.1mol,硝酸浓度是1.0mol/L。反应中还同时生成0.05molNO,因此剩余气体是由氮气和NO组成的,且二者的体积之比是1︰1的,所以剩余气体中氮元素与氧元素的质量之比为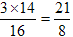 ,所以答案选CD。
,所以答案选CD。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:阅读理解
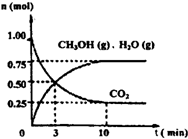 (2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.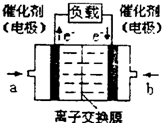
查看答案和解析>>
科目:高中化学 来源:2009-2010学年河南省郑州市高一(上)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com