
A.0.3 mol HNO3 B.3.612×1023个HNO3分子
C.0.1 mol H3PO4 D.0.2 mol CH4
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
(14分)在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料。
(1)CH4可与Cl2反应,其反应机理如下:
(2)Cl2→2Cl2 △H=+243 kJ·mol-1
则CH4与Cl2反应生成CH3Cl(g)的热化学方程式为:________
(2)在一定条件下,发生反应:CH4(g)+H2O(g)ClO(g)+3H2(g)△H>0。
在其它条件不变的情况下降低温度,逆反应速率将________(填“增大”、“减小”或“不变”)。若在2L密闭容器中发生反应,T℃时,通入2mol CH4(g)和2 mol H2O(g),反应达平衡后,生成l mol CO,此时向容器中同时加入1mol CO和3 molH2的混合气体(保持温度不变),则平衡将 _______(填“向正反应方向”、“向逆反应方向”或“不”)移动,达到新平衡后平衡常数_______
(3)CH4(g)和H2O(g)生成的CO和H2在一定条件下可发生反应CO(g)+2H2(g)CH3OH(g)△H=—90.1kJ·mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有________(选填序号)。
a.再充入1mol H2 b.使用健化剂 c.再充入2 mol CO d.升高温度
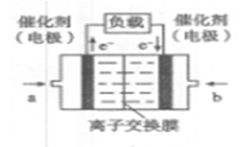
(4)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如下图所示:则正极的电极反应式为________;反应一段时间后溶液的pH________(填“升高”、“降低”
或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(9分)(1)已知:NN的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程式 ;
该反应的熵变△S 0(填“>”、“<”或“=”)。
(2)将1 mol N2与3 molH2混合置于容积为10 L的密闭容器中。
①温度为T1时,混合气体中氨的物质的量分数为25%,则N2的转化率为 。
②当温度由T1变化到T2(T2 >T1)时(如图),平衡常数KA KB(填“>”、“<”或“=”)。
③温度在T1时,若起始时向10L密闭容器中加入N2 0.5 mol、H2 1.5 mol、NH3 1 mol。当反应达到平衡时,与起始时比较, (填化学式)的物质的量增加。
查看答案和解析>>
科目:高中化学 来源:2011届河南省开封市高三一模考试化学试卷 题型:填空题
CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。
(1)其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)===C2 H4(g)+3O2(g) △H=十1411.0kJ/mol
2CO2(g) +3H2 O(l)=C2 H5OH(1)十3O2(g)△H = +1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为 。
(2)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
 温度(K) 温度(K)CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
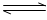 CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。
CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。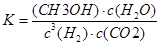
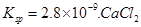 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为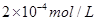 ,则生成沉淀所需CaCl2溶液的最小浓度为 。
,则生成沉淀所需CaCl2溶液的最小浓度为 。查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省唐山市高三上学期摸底考试理科综合化学试卷 题型:填空题
(14分)在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料。
(1)CH4可与Cl2反应,其反应机理如下:
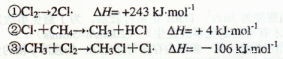
(2)Cl2→2Cl2 △H= +243 kJ·mol-1
则CH4与Cl2反应生成CH3Cl(g)的热化学方程式为:________
(2)在一定条件下,发生反应:CH4(g)+H2O(g) ClO(g)+3H2(g)△H>0。
ClO(g)+3H2(g)△H>0。
在其它条件不变的情况下降低温度,逆反应速率将________(填“增大”、“减小”或“不变”)。若在2L密闭容器中发生反应,T℃时,通入2 mol CH4(g)和2 mol H2O(g),反应达平衡后,生成l mol CO,此时向容器中同时加入1mol CO和3 molH2的混合气体(保持温度不变),则平衡将 _______(填“向正反应方向”、“向逆反应方向”或“不”)移动,达到新平衡后平衡常数_______
(3)CH4(g)和H2O(g)生成的CO和H2在一定条件下可发生反应CO(g)+2H2(g)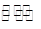 CH3OH(g)△H=—90.1kJ·mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有________(选填序号)。
CH3OH(g)△H=—90.1kJ·mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有________(选填序号)。
a.再充入1 mol H2 b.使用健化剂 c.再充入2 mol CO d.升高温度
(4)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如下图所示:则正极的电极反应式为________;反应一段时间后溶液的pH________(填“升高”、“降低”
或“不变”)。
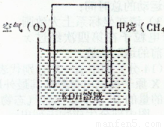
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com