
 ;Al与NaOH溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
;Al与NaOH溶液反应的离子方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.分析 (1)Al的质子数为13,原子结构中存在3个电子层,最外层电子数为3,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气;
(2)根据质量数=质子数+中子数,计算中子数;根据晶体的性质和成键方式判断晶体的类型,SiO2的晶体类型为原子晶体;
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则Y是第VIIA元素,氢化物的沸点随着相对分子质量的增大而增大,但含有氢键的氢化物沸点反常;
(4)由药皮的成分和物质的性质进行推断产生的使金属不被氧化的气体成分为二氧化碳;
(5)36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,二氧化硅不和盐酸反应,所以分离得到11.0g的固体是二氧化硅,滤液中加入过量NaOH溶液,分离得到21.4g固体是氢氧化铁,根据铁原子守恒计算氧化铁的质量,剩余的质量就是氧化铝,再根据质量分数公式进行计算.
解答 解:(1)Al的质子数为13,原子结构中存在3个电子层,最外层电子数为3,其原子结构示意图为 ,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为: ;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)在原子符合的表达式中左上角表示质量数,左下角表示质子数,根据质量数=质子数+中子数可计算出30Si的原子的中子数为:30-14=16,故答案为:16;
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则Y是第VIIA元素,氢化物的沸点随着相对分子质量的增大而增大,但HF中含有氢键导致HF的沸点大于HCl,所以该族氢化物中沸点最低的是HCl,
故答案为:HCl;
(4)由药皮的成分大理石、水泥、硅铁可知,在高温下只有大理石才分解产生CO2,因此气体只能是CO2气体,
故答案为:CO2;
(5)36.0g(仅含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,二氧化硅不和盐酸反应,所以分离得到11.0g的固体是二氧化硅;
当滤液中加入过量NaOH溶液时AlCl3生成NaAlO2,FeCl3生成Fe(OH)3沉淀,所以分离得到21.4g固体是氢氧化铁,根据2Fe(OH)3→Fe2O3,氧化铁的质量=$\frac{160×21.4}{214}$g=16g,氧化铝的质量=(36.0-11.0-16)g=9g,氧化铝的质量分数=$\frac{9g}{36g}$×100%=25%,
故答案为:25%.
点评 本题考查混合物分离提纯及原子结构,为高频考点,把握物质的性质、混合物分离方法选择、原子构成等为解答的关键,侧重分析与应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
| c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
| v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
| 反应阶段 | 速率方程 | $\frac{k(297.0K)}{k(291.5K)}$ |
| 富氧区 | v=kc(SO32-)•c(O2) | 1.47 |
| 贫氧区 | v=kca(SO32-)•cb(O2) | 2.59 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | 操作1 | 操作2 | 操作3 | 操作4 |
| A | 溶解 | 结晶 | 蒸发 | 过滤 |
| B | 蒸发 | 过滤 | 冷却 | 过滤 |
| C | 蒸发 | 结晶 | 结晶 | 蒸发 |
| D | 过滤 | 结晶 | 冷却 | 结晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3)为置换反应 | B. | (1)(2)(3)均为氧化还原反应 | ||
| C. | (2)为化合反应 | D. | 反应物中硅元素均被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
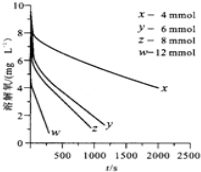
| A. | 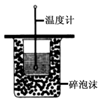 进行中和热的测定 | |
| B. | 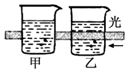 运用该实验可区分胶体和溶液 | |
| C. | 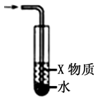 X若为苯,可用于吸收NH3或HCl,并防止倒吸 | |
| D. |  验证AgCl溶解度大于Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
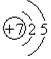
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: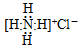 | |
| B. | 对硝基甲苯: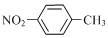 | |
| C. | 碳酸的电离方程式:H2CO3?2H++CO${\;}_{3}^{2-}$ | |
| D. | 硫离子的结构示意图: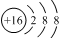 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
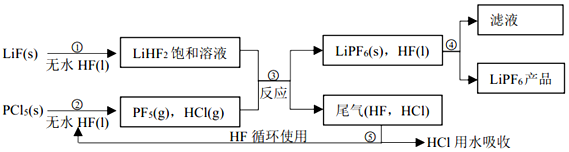
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com