



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��15�֣��Ȼ����dz�����ˮ����������ˮ�Ȼ������۵�Ϊ555K���е�Ϊ588K����ҵ�Ʊ��Ȼ�����һ�ֹ������£�
�ش���������
��1��ȡ0.5mL�Ȼ�����Һ����50mL��ˮ�У������Ƭ�̵ú��ɫ��Һ�壬�ù��̿������ӷ���ʽ��ʾΪ ��
��2����֪FeCl3��6H2O��ˮ�е��ܽ�����£�
| �¶�/�� | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| �ܽ�ȣ�g/100gH2O�� | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
��FeCl3��Һ�л��FeCl3��6H2O�ķ����� ��
��3�����������¶ȳ���673K��������Է�������Ϊ325�����ʣ������ʵĻ�ѧʽΪ ��
��4������ʱ��FeCl3��Һ�еμ�NaOH��Һ������Һ��c(Fe3+)��1.0��10-5 mol��L-1ʱ������Fe3+������ȫ����Fe3+������ȫ��pH����Ϊ ����֪Ksp��Fe(OH)3��=1.0��10-38����
��5�����ռ�X�� �������������ռ�X�������� ��
��6���ⶨ��Ʒ��FeCl3�����������ķ����ǣ�
a����ȡmg��ˮ�Ȼ�����Ʒ������ϡ���ᣬ��ת�Ƶ�100mL����ƿ��������ˮ����
b��ȡ��10mL������Һ����ƿ�У������Թ�����KI��Һ��ַ�Ӧ
c���Ե�����ָʾ������b mol��L-1Na2S2O3��Һ�ζ���I2+2 Na2S2O3=Na2S4O6+2NaI��������ȥVmL������Ʒ���Ȼ�������������Ϊ ��
�����������취�ⶨ����Ʒ��FeCl3����������ƫ�ͣ��ⶨ�����в��������ɺ��ԣ�����ԭ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�콭��ʡ������ѧ��������ѧ����һ��ѧ������ѧ��������ѧ�Ծ� ���ͣ������
��15�֣��Ȼ����dz�����ˮ����������ˮ�Ȼ������۵�Ϊ555K���е�Ϊ588K����ҵ�Ʊ��Ȼ�����һ�ֹ������£�
�ش���������
��1��ȡ0.5mL�Ȼ�����Һ����50mL��ˮ�У������Ƭ�̵ú��ɫ��Һ�壬�ù��̿������ӷ���ʽ��ʾΪ ��
��2����֪FeCl3��6H2O��ˮ�е��ܽ�����£�
| �¶�/�� | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| �ܽ�ȣ�g/100gH2O�� | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�������ʮ�������ص�У������һ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
�������ȣ�ClO2���ڳ�������һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ��59�����е�Ϊ11��0����������ˮ����ҵ�����Գ�ʪ��KClO3�Ͳ��ᣨH2C2O4����60��ʱ��Ӧ�Ƶá�ijѧ��������ͼ��ʾװ��ģ�ҵ��ȡ���ռ�ClO2��
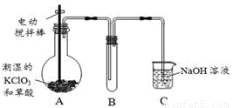
��1��A�з�Ӧ������K2CO3��ClO2��CO2�ȣ���д���÷�Ӧ�Ļ�ѧ����ʽ��??????????????????????????? ��
��2��A���������¶ȿ���װ�ã����ƾ����⣬����Ҫ�IJ����������ձ���??????????????? ��
Bװ�ñ�����ڱ�ˮԡ�У���ԭ����??????????????????????????????? ��
��3����Ӧ����װ��C�пɵ�NaClO2��Һ����֪NaClO2������Һ���¶ȵ���38��ʱ����������NaClO2��3H2O�����¶ȸ���38��ʱ����������NaClO2���벹���NaClO2��Һ���Ƶ�NaClO2����IJ������裺��???????????????????? ����??????????????????? ����ϴ�ӣ������
��4��ClO2�ܲ��ȶ������������ƣ�������ˮ���յõ�ClO2��Һ��Ϊ�ⶨ������Һ��ClO2�ĺ���������������ʵ�飺
����1��ȷ��ȡClO2��Һ10��00 mL��ϡ�ͳ�100��00 mL��������ȡV1 mL�������뵽��ƿ�У�
����2����ϡ�������������pH��2��0������������KI���壬����Ƭ�̣�
����3���������ָʾ������c mol/L Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��ҺV2 mL������֪2 Na2S2O3 + I2 ��Na2S4O6 + 2NaI��
������100 mL c mol/LNa2S2O3����Һʱ���õ��IJ����������ձ�����Ͳ����������У�???????????????????????? ��
���ζ��������������������ƽ�вⶨ��ԭ����???????????????????????????????? ��
��д������2�з�����Ӧ�����ӷ���ʽ?????????????????????????????????? ��
��ԭClO2��Һ��Ũ��Ϊ???????????????? g / L���ò����е���ĸ����ʽ��ʾ����
�����ζ�ǰ�ζ��ܼ����������ݣ��ζ���������ʧ����ⶨ���????????????? ��
���ζ���ʼ���Ӷ������ζ��յ�ʱ��ȷ��������ⶨ���?????????????????? ��
������ƫ������ƫ�������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ��������ѧ����һ��ѧ������ѧ��������ѧ�Ծ� ���ͣ������
��15�֣��Ȼ����dz�����ˮ����������ˮ�Ȼ������۵�Ϊ555K���е�Ϊ588K����ҵ�Ʊ��Ȼ�����һ�ֹ������£�
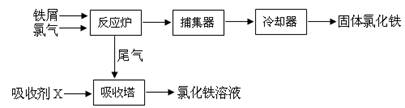
�ش���������
��1��ȡ0.5mL�Ȼ�����Һ����50mL��ˮ�У������Ƭ�̵ú��ɫ��Һ�壬�ù��̿������ӷ���ʽ��ʾΪ ��
��2����֪FeCl3��6H2O��ˮ�е��ܽ�����£�
|
�¶�/�� |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
|
�ܽ�ȣ�g/100gH2O�� |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
��FeCl3��Һ�л��FeCl3��6H2O�ķ����� ��
��3�����������¶ȳ���673K��������Է�������Ϊ325�����ʣ������ʵĻ�ѧʽΪ ��
��4������ʱ��FeCl3��Һ�еμ�NaOH��Һ������Һ��c(Fe3+)��1.0��10-5 mol��L-1ʱ������Fe3+������ȫ����Fe3+������ȫ��pH����Ϊ ����֪Ksp��Fe(OH)3��=1.0��10-38����
��5�����ռ�X�� �������������ռ�X�������� ��
��6���ⶨ��Ʒ��FeCl3�����������ķ����ǣ�
a����ȡmg��ˮ�Ȼ�����Ʒ������ϡ���ᣬ��ת�Ƶ�100mL����ƿ��������ˮ����
b��ȡ��10mL������Һ����ƿ�У������Թ�����KI��Һ��ַ�Ӧ
c���Ե�����ָʾ������b mol��L-1Na2S2O3��Һ�ζ���I2+2 Na2S2O3= Na2S4O6+2NaI��������ȥVmL������Ʒ���Ȼ�������������Ϊ ��
�����������취�ⶨ����Ʒ��FeCl3����������ƫ�ͣ��ⶨ�����в��������ɺ��ԣ�����ԭ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ģ���� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com