
科目:高中化学 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:013
用CO还原5.0g某赤铁矿石(主要成分为Fe2O3,杂质不参加反应)样品,生成的CO2再跟过量的石灰水反应得到6.8g沉定,则该赤铁矿中Fe2O3的质量分数
[ ]
查看答案和解析>>
科目:高中化学 来源:2007届汕头澄海华侨中学化学氧化还原单元练习(人教) 人教 题型:022
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学探究学习小组拟利用下列装置测定某黑色铁的氧化物矿样的化学式(设矿样不含其它杂质)。主要化学反应为:
①H2C2O4(乙二酸)CO2↑+CO↑+H2O ②Fe![]() O
O![]() +
+![]() CO=
CO=![]() Fe+
Fe+![]() CO2
CO2
他们要测定的数据是矿样质量和反应②所生成的CO2的质量[用m(Fe![]() O
O![]() )和m(CO2)表示]。所需仪器(连同药品)的示意图如下(必要时有的仪器可重复使用)
)和m(CO2)表示]。所需仪器(连同药品)的示意图如下(必要时有的仪器可重复使用)
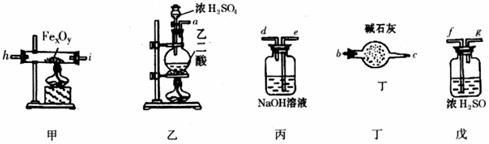
(1)假设洗气(或吸气)装置丙、丁、戊内的反应进行得都完全,按气体从左至右的流向将上述仪器组装起来(用接口字母a、b……表示):
接 , 接 , 接 , 接 , c 接 f
(2)实验中有一件仪器前后用到两次,前边用它的目的是 ,后边又用它的目的是 。
(3)为了保护环境,怎样处理仪器末端导出的CO(写出具体方法)
(4)该小组测得m(Fe![]() O
O![]() )=15.2g,m(CO2)=11.0g,则x:y为
)=15.2g,m(CO2)=11.0g,则x:y为
A.4:5 B.1:1 C.2:3 D.3:4
在该实验中,反应前Fe![]() O
O![]() 为黑色,反应后生成的Fe也为黑色,难以确定Fe
为黑色,反应后生成的Fe也为黑色,难以确定Fe![]() O
O![]() 是否完全被还原,若仍有Fe
是否完全被还原,若仍有Fe![]() O
O![]() 剩余,则所测的x:y值比实际值 (填偏低,偏高或不影响)采取什么措施可以避免上述原因引起的偶然误差:
剩余,则所测的x:y值比实际值 (填偏低,偏高或不影响)采取什么措施可以避免上述原因引起的偶然误差:
(5)仍用上述提供的仪器和药品(必要时可以少选用也可以按新的顺序进行组装),同样测定两种物质的质量,便可计算出x和y的比值,写出要测定的两种数据可能的组合:
① ② ③
(若不够三种组合,可不必填满;若多于三种组合,可自行增加)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com