
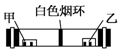
| A. | 浓硝酸与浓氨水 | B. | 浓硫酸与浓氨水 | ||
| C. | 浓盐酸与浓氯化铵溶液 | D. | 浓硝酸与浓氢氧化钠溶液 |
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 水蒸气含有的分子数为1NA | |
| B. | 常温常压下,32 g O2含有的原子数为2个 | |
| C. | 常温常压下,NA个CO2分子占有的体积为22.4 L | |
| D. | 体积为1L、物质的量浓度为0.5 mol/L的氯化钙溶液中,含有Cl-个数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 | |
| B. | 电池的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变,且溶液中有Na2CO3﹒10H2O晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 分别加水稀释10倍、四种溶液的pH:①>②>④>③ | |
| B. | 温度下降10℃,四种溶液的pH均不变 | |
| C. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c(Cl-)<c(NH4+)<c(H+)<c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:10:100:1 | B. | 1:10-1:10-12:10-14 | ||
| C. | 14:13:12:14 | D. | 1:2:12:14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟离子易与钛离子形成可溶性难电离物质 | |
| B. | 氢氟酸的氧化性比其他酸强 | |
| C. | 氢氟酸的还原性比其他酸强 | |
| D. | 氢氟酸的酸性比其他酸强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com