
【题目】下列反应中,二氧化硫表现氧化性的是( )
A.2SO2+O2![]() 2SO3
2SO3
B. SO2+H2O![]() H2SO3
H2SO3
C.2H2S+SO2=3S↓+2H2O
D.SO2+2H2O+Cl2=H2SO4+2HCl
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为ax mol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() x mol
x mol
A. ① B. ①② C. ①④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某学生用0.1 mol·L-1H2SO4溶液滴定0.1 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定终点的判定有误差:①少滴了一滴H2SO4溶液;②多滴了一滴H2SO4溶液(1滴为0.05 mL),则①和②两种情况下所得溶液的pH之差是( )
A. 4B. 4.6C. 5.4D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某化学学习小组为探究NO2和SO2的反应,进行如下实验(如图所示)。
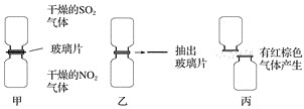
①图甲两集气瓶中________(填“上”或“下”)瓶颜色深。
②图乙中反应的现象是___________________________________________________。
③图丙中“有红棕色气体产生”说明SO2和NO2反应的产物中有____________,说明NO2在该反应中显____________性。
④由图乙和图丙中的现象写出NO2和SO2反应的化学方程式:________________________。
(2)某课外活动小组探究镁与NO2的反应。已知镁与CO2反应如下:2Mg+CO2![]() 2MgO+C
2MgO+C
①该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测,写出Mg与NO2反应的化学方程式:______________________________________________________。
②设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)
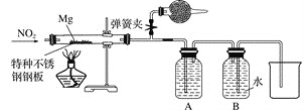
资料信息:2NO2+2NaOH===NaNO3+NaNO2+H2O
Ⅰ.装置A中的试剂是____________。
Ⅱ.干燥管和装置B的作用分别是________________________________________________、____________________。
Ⅲ.实验开始时正确的操作步骤是__________。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.00mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
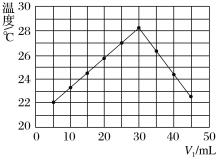
A.该实验表明化学能可以转化为热能
B.做该实验时环境温度为22℃
C.NaOH溶液的浓度约为1.00mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:

![]()
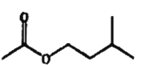 +H2O
+H2O
物质 | 相对分子质量 | 密度 | 沸点/℃ | 水中溶解性 |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)仪器A的名称是:________
(2)在洗涤操作中,第一次水洗的主要目的是:________;第二次水洗的主要目的是:________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c..先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:________________。
(5)实验中加入少量浓硫酸的目的是:________________。
(6)在蒸馏操作中加热一段时间发现忘加碎瓷片,应采取的正确操作是:________。(请用文字描述)
(7)本实验的产率是:________(
a.30% b.40% c.50% d.60%
(8)在进行蒸馏操作时,若从110℃便开始收集馏分,会使实验的产率偏________(填“高”或“低”),其原因是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍广泛应用于电镀、催化、医药等行业中,具有很高的经济价值。一种用含镍废催化剂(主要含![]() 、C,还含有铝、铁的单质及氧化物,和少量有机物)为原料制备
、C,还含有铝、铁的单质及氧化物,和少量有机物)为原料制备![]() 的工艺流程如下:
的工艺流程如下:

部分阳离子以氢氧化物形式沉淀时的![]() 如下:
如下:
沉淀物 | 开始沉淀时的 | 完全沉淀时的 |
| 2.7 | 3.2 |
| 7.6 | 9.7 |
| 7.1 | 9.2 |
回答下列问题:
(1)滤液a中溶质的主要成分除![]() 外,还含有_________________(填化学式)。
外,还含有_________________(填化学式)。
(2)酸溶前需进行“热处理”的主要目的是____________;滤渣b主要成分是________(填化学式)。
(3)加入![]() 溶液时发生反应的离子方程式为_______;简述加入
溶液时发生反应的离子方程式为_______;简述加入![]() 除杂的原理_______。
除杂的原理_______。
(4)操作d为________、过滤、洗涤、干燥;产品晶体中有时会混有少量![]() ,其原因可能是__________。(写出一点即可)
,其原因可能是__________。(写出一点即可)
(5)取ag上述流程制得的硫酸镍晶体样品溶于蒸馏水中,在不断搅拌下缓慢加入足量丁二酮肟溶液![]() ,再加入
,再加入![]() 溶液调节溶液的
溶液调节溶液的![]() 在8~9,充分反应后,过滤、洗涤、烘干、称量得到红色固体质量为bg。发生反应的方程式为
在8~9,充分反应后,过滤、洗涤、烘干、称量得到红色固体质量为bg。发生反应的方程式为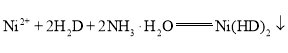 (红色)
(红色)![]() ,已知
,已知![]() 相对分子质量为M,列式计算样品纯度为_________。
相对分子质量为M,列式计算样品纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
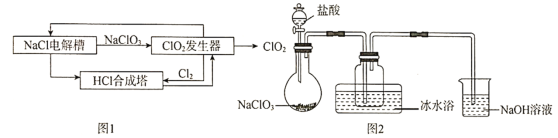
【题目】二氧化氯![]() 是一种高效、安全的消毒剂,常温下是一种黄绿色气体,11℃时液化成红棕色液体,易溶于水但不与水反应。工业上著名的开斯汀法制备二氧化氯的部分流程图如图1。某研究小组用图2装置模拟
是一种高效、安全的消毒剂,常温下是一种黄绿色气体,11℃时液化成红棕色液体,易溶于水但不与水反应。工业上著名的开斯汀法制备二氧化氯的部分流程图如图1。某研究小组用图2装置模拟![]() 发生器中的反应来制备
发生器中的反应来制备![]() (夹持装置已略去)
(夹持装置已略去)
(1)写出![]() 与盐酸反应的化学方程式。_____________
与盐酸反应的化学方程式。_____________
(2)冰水浴的作用是_____________。
(3)![]() 溶液中发生的主要反应的离子方程式为_______。
溶液中发生的主要反应的离子方程式为_______。
(4)将![]() 通入到
通入到![]() 溶液中,再向其中加入适量
溶液中,再向其中加入适量![]() ,振荡、静置,观察到_________,证明
,振荡、静置,观察到_________,证明![]() 具有氧化性。
具有氧化性。
(5)![]() 常用作自来水消毒剂,碘量法可以检测水中
常用作自来水消毒剂,碘量法可以检测水中![]() 的浓度,步骤如下:
的浓度,步骤如下:
①取![]() 水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝(已知
水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝(已知![]() 全部转化为
全部转化为![]() );
);
②用![]() 的
的![]() 溶液滴定,消耗
溶液滴定,消耗![]() 溶液
溶液![]() (已知:
(已知: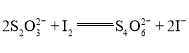 );
);
确定操作②达到滴定终点的现象是______;经计算,水样中![]() 的浓度是_________
的浓度是_________![]() 。
。
(6)一定温度和电压下,电解精制食盐水可制得![]() 和
和![]() 。
。
已知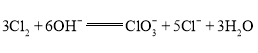 ,电解时应选用___交换膜(填“阳离子”或“阴离子”),阴极电极反应式为___。
,电解时应选用___交换膜(填“阳离子”或“阴离子”),阴极电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
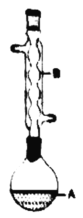
【题目】100mL0.50mol/L盐酸与100mL0.55mol/LNaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
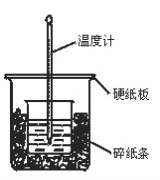
(1)从实验装置图看,尚缺少的一种玻璃仪器是________。
(2)烧杯间填充碎纸条的作用是_________。
(3)按如图装置进行实验,测得中和热的数值_______(填“偏大”“偏小”或“无影响”)其原因是_____。
(4)若实验中改用80 mL0.50mol/L盐酸跟80mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_____(填“相等、“不相等”)。
(5)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.5 |
依据该学生测得的实验数据进行计算,中和热ΔH=______(结果保留一位小数)。
(6)能否用稀Ba(OH)2溶液和稀硫酸代替氢氧化钠溶液和盐酸反应测定中和热_______(填“能”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com