
| A. | 晶体区别于非晶体的本质特征是晶体中原子呈周期性有序排列 | |
| B. | 缺角的氯化钠晶体在饱和NaCl溶液中慢慢变为的立方体晶体体现了晶体的自范性 | |
| C. | M为第ⅡA元素,MCO3中M2+半径越大,MCO3热分解温度越低 | |
| D. | 干冰中CO2的配位数12大于冰中H2O的配位数4,是由于丙中水分子之间存在氢键 |
分析 A.晶体中原子排列有序;
B.晶体的自范性是指晶体能自发地呈现多面体外形的性质;
C.M为第ⅡA元素,MCO3中M2+半径越大,碳酸盐越难分解;
D.范德华力没有饱和性,氢键有饱和性.
解答 解:A.晶体中粒子在微观空间里呈现周期性的有序排列,非晶体中微粒排列无序,故A正确;
B.晶体的自范性是指晶体能自发地呈现多面体外形的性质,缺角的氯化钠晶体在饱和NaCl溶液中慢慢变为的立方体晶体体现了晶体的自范性,故B正确;
C.M为第ⅡA元素,MCO3中M2+半径越大,碳酸盐越难分解,所以MCO3中M2+半径越大,MCO3热分解温度越高,故C错误;
D.范德华力没有饱和性,氢键有饱和性,所以冰中水分子的配位数小,故D正确.
故选C.
点评 本题考查了晶体与非晶体的区别,注意把握晶体与非晶体的本质区别是晶体中原子呈周期性有序排列,注意把握晶体自范性的含义,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
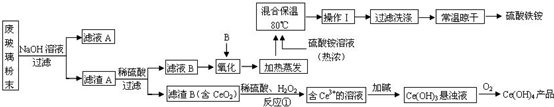

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 定容时仰视刻度线 | B. | 转移溶液后未洗涤烧杯和玻璃棒 | ||
| C. | 定容时俯视刻度线 | D. | 移液前容量瓶中有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
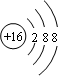 ,32g甲在足量浓硝酸中反应转移的电子数为2NA.
,32g甲在足量浓硝酸中反应转移的电子数为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 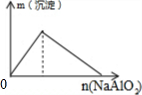 向盐酸中滴入NaAlO2溶液 | B. | 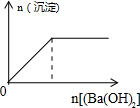 NaHSO4溶液中逐滴加入Ba(OH)2溶液 | ||
| C. | 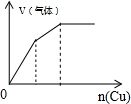 将铜粉加入到一定浓硝酸中 | D. | 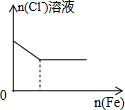 将铁粉加入到一定量氯化铁溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol/L | 0.1 | 0.2 | 0 |
| 平衡浓度/mol/L | 0.05 | 0.05 | 0.1 |
| A. | 前3 min内,用Y的变化量表示的平均反应速率v(Y)=0.05mol•L-1•min-1 | |
| B. | 反应达到平衡时,X的转化率为50% | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| D. | 反应可表示为X+3Y?2Z,其平衡常数为1600 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm互为同位素 | |
| B. | 氯气能使潮湿的蓝布条变为白色,说明氯气有漂白性 | |
| C. | 将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L | |
| D. | 焰色反应发生的是物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com