
| ��� | 10%�������/mL | �¶�/�� | �������� |
| �� | 2mL | 20 | |
| �� | 2mL | 20 | 10�α���MnSO4��Һ |
| �� | 2mL | 30 | |
| �� | 1mL | 20 | 1mL����ˮ |
���� ��1��2MnO4-+5H2C2O4+6H+=2Mn2++10CO2��+8H2O�У�����MnԪ�صĻ��ϼ۽��ͣ�CԪ�صĻ��ϼ������жϣ�
��2���о������Ի�ѧ��Ӧ���ʵ�Ӱ�죬Ӧ��֤�¶ȡ�Ũ����ͬ���о��¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧ��֤Ũ����ͬ����ʹ�ô�����
��3��ʵ���͢��������Ũ�Ȳ�ͬ��������ˮĿ��������Һ���������ͬ��
��� �⣺��1��2MnO4-+5H2C2O4+6H+=2Mn2++10CO2��+8H2O�У�MnԪ�صĻ��ϼ۽��ͣ�CԪ�صĻ��ϼ����ߣ�MnO4-Ϊ��������H2C2O4Ϊ��ԭ����
�ʴ�Ϊ��H2C2O4��
��2���о������Ի�ѧ��Ӧ���ʵ�Ӱ�죬Ӧ��֤�¶ȡ�Ũ����ͬ����ѡʵ����о��¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧ��֤Ũ����ͬ����ʹ�ô�������ѡʵ���
�ʴ�Ϊ����
��3��ʵ���͢��������Ũ�Ȳ�ͬ�����о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬����������ˮȷ����ʵ�����������ȣ�ȷ���Ա�ʵ����c��KMnO4����c��H2C2O4����ͬ��ֻ�â�͢�������Ũ�Ȳ�ͬ��
�ʴ�Ϊ�������Ũ�ȣ��������ӵ�Ũ�ȣ���ȷ���Ա�ʵ����c��KMnO4����c��H2C2O4����ͬ��
���� ���⿼��������ԭ��Ӧ��Ӱ�췴Ӧ���ʵ����أ�ע����Ʊ������о�Ӱ�����أ����ձ����е����ݷ�����Ӧ�ã���Ŀ�Ѷ����У�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����״̬��������صĵ��뷽��ʽ��KHSO4�TK++H++SO42- | |
| B�� | Cl-�Ľṹʾ��ͼ��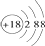 | |
| C�� | ������Ϊ8��̼ԭ�ӣ�${\;}_{6}^{14}$C | |
| D�� | NaCl�ĵ���ʽ��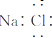 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
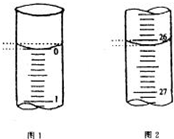 �к͵ζ��ǻ�ѧ����ʵ��֮һ��ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�����������Һ������д���пհף�
�к͵ζ��ǻ�ѧ����ʵ��֮һ��ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�����������Һ������д���пհף�| �ζ����� | ��������������Һ�����/mL | 0.1000mol/L ��������/mL | ||
| �ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
| ��һ�� | 25.00 | |||
| �ڶ��� | 25.00 | 2.00 | 28.08 | 26.08 |
| ������ | 25.00 | 0.22 | 26.34 | 26.12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢ� | B�� | �٢� | C�� | �٢ڢ� | D�� | �٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HF�ĵ���ʽΪ | B�� | Mg2+�Ľṹʾ��ͼΪ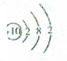 | ||
| C�� | CO2�ĵ���ʽΪ��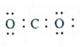 | D�� | Cl-�Ľṹʾ��ͼΪ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
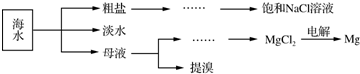
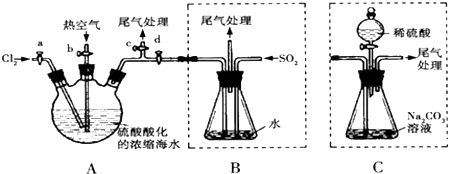
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com