
NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA
B.0.1 mol/L NH4Cl溶液中Cl-离子数目为0.1 NA
C.反应3H2(g)+N2(g)  2NH3(g) ΔH=-92 kJ/mol,放出热量9.2 kJ时,转移电子0.6 NA
2NH3(g) ΔH=-92 kJ/mol,放出热量9.2 kJ时,转移电子0.6 NA
D.0.1 mol H2O2分子中含极性共价键数目为0.3 NA
科目:高中化学 来源:2017届海南中学高三上第二次月考化学试卷(解析版) 题型:选择题
为鉴别K2CO3和NaHCO3两种白色固体,有4位同学为鉴别它们,分别设计了下列四种不同的方法,其中不可行的是( )
A.分别取样配成溶液,分别往两份溶液中逐滴滴加几滴稀盐酸,一开始就有气体产生的为NaHCO3
B.分别取样加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
C.分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀
D.分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,直接观察火焰的颜色
查看答案和解析>>
科目:高中化学 来源:2017届湖南省邵阳市高三上第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式中,只能表示一个化学反应的是( )
①Ag++Cl-===AgCl↓
②Ba2++2OH-+2H++SO ===BaSO4↓+2H2O
===BaSO4↓+2H2O
③CO +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
④Fe+Cu2+===Fe2++Cu
A.①③ B.②④ C.②③ D.没有
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期调研测试化学试卷(解析版) 题型:填空题
日常生活和生产与化学紧密相连。
(1)“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。所谓“纳米材料”是指研究、开发出的微粒粒度从几纳米至几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是____________。
A.能全部透过半透膜 B.有丁达尔效应
C.所得液体不稳定,会分层 D.所得物质一定是悬浊液
(2)把淀粉溶液溶于沸水中,制成淀粉胶体,回答下列问题。
①可以利用____________鉴别水溶液和胶体。
②60℃左右时,在淀粉胶体中加入淀粉酶,装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸镏水的烧杯里充分反应。从半透膜里析出的物质是___________,该操作的名称是__________。
(3)生活和生产中常用到胶体的性质,请看下述几例:
①手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原理是______________。
②水泥和冶金工厂常用高压电对气溶胶作用以除去大量烟尘,减少对空气的污染,这种作用运用了________原理。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期调研测试化学试卷(解析版) 题型:选择题
下列图示与对应的叙述不相符合的是( )
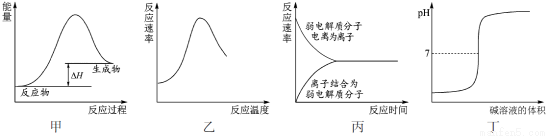
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
查看答案和解析>>
科目:高中化学 来源:2017届湖北省黄冈市高三上学期第一次调研化学试卷(解析版) 题型:实验题
Pb为第IVA 元素,常见的化合价为+2和+4,其单质和化合物都有着广泛的用途,如制铅蓄电池,化工耐酸设备及防X射线材料等,请回答下列问题。
(1)PbO2具有强氧化性,在加热时可与浓盐酸反应制Cl2,发生的化学方程式为_________________;
(2)Fe3O4属于混合氧化物,其组成可表示为FeO·Fe2O3,Pb3O4和Fe3O4一样,也属于混合氧化物,其组成也可表示为__________;
PbO也是一种重要的物质。工业上生产锌钡白(ZnS·BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,实验室利用该废渣生产PbO的流程如下。

过程中发生的部分反应如下:
浸泡:PbSO4(s)+2Cl-(aq) PbCl2(s)+SO42-(aq)
PbCl2(s)+SO42-(aq)
溶【解析】
PbC12+2Cl-=PbCl42-;PbCl42-+OH-=PbOHCl↓+3Cl-
有关数据:不同温度和浓度的食盐溶液中PbC12的溶解度(g/L)
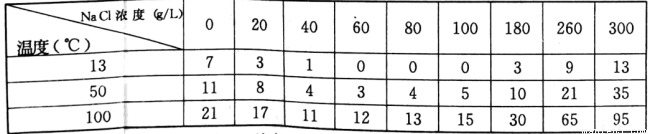
(3)浸泡溶解时采用95℃的高温,其主要目的有_____________(答两条);
(4)溶液C中的溶质主要成份是___________,在实验室里,将溶质分离出来需要用到的玻璃仪器有__________;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,则废渣中PbSO4的质量分数为__________(用百分数表示,精确到小数点后一位)。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省黄冈市高三上学期第一次调研化学试卷(解析版) 题型:选择题
有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:
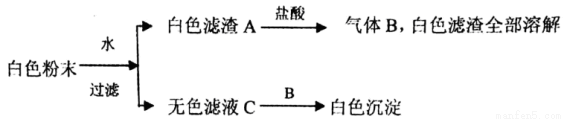
下列判断正确的是( )
A. BaCl2,CaCO3一定存在,NaOH可能存在
B. K2SO4、CuSO4一定不存在
C. K2SO4、NaOH、CaCO3、BaCl2一定存在,K2SO4可能存在
D. C为单一溶质溶液
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:填空题
(1)配制100mL 1mol·L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4 (密度为1.84 g·mL-1,质量分数为98%)的体积为_______mL。
(2)等温等压下,等体积的CO2和O3所含分子个数比为 ,原子个数比为 ,密度比为 。
(3)有12.4g Na2R含Na+ 为0.4mol,则Na2R的摩尔质量为 ,R的相对原子质量为 。
(4)在标准状况下1.7g氨气所占的体积为 L,它与同条件下 mol H2S含有相同的氢原子数。
(5)100mL 0.5mol/L的(NH4)2SO4溶液中含有NH4+_______________mol,这些NH4+中所含有的电子数为___________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上第一次月考化学试卷(解析版) 题型:选择题
对于平衡CO2(g) CO2(aq) ΔH=-19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是
CO2(aq) ΔH=-19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是
A.升温增压 B.降温减压 C.升温减压 D.降温增压
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com