
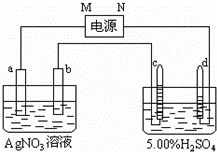
图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.回答:
(1)直流电源中,M为 极.
(2)Pt电极上生成的物质是银,其质量为 g.
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2: : :1.
(4)AgNO3溶液的浓度(填增大、减小或不变.下同) ,AgNO3溶液的pH ,H2SO4溶液的浓度 ,H2SO4溶液的pH .
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液的质量为 g.
考点: 电解原理.
专题: 电化学专题.
分析: (1)5.00%的稀H2SO4,实际上是电解其中的水.阴极产生H2,阳极产生O2,依据装置图中 电极气体体积分析,c电极是氧气,d电极生成的是氢气,依据电解原理分析判断电极;
(2)依据(1)分析判断a为阳极,b为阴极,所以是电镀装置,依据电子守恒计算得到;
(3)依据电极反应和电子守恒计算得到;
(4)装置中是电镀装置,电解质溶液浓度不变,溶液PH不变;电解硫酸溶液是电解水,硫酸溶液浓度增大;
(5)分析可知电解过程中是电解水,依据溶质不变列式计算;
解答: 解:(1)5.00%的稀H2SO4,实际上是电解其中的水.阴极产生H2,阳极产生O2,且V(H2):V(O2)=2:1,依据装置图中 电极气体体积分析,可确定d极为阴极,则电源的N极为负极,c极为阳极,b为阴极,a为阳极,M为正极;故答案为:正;
(2)依据硫酸溶液电解水的反应,V(H2)=336mL×2/3=224mL,即为0.01mol,V(O2)=336mL×1/3=112mL,即为0.005mol.说明电路上有0.02mol电子,因此在b极(Pt、阴极)产生Ag:0.02×108=2.16g;
故答案为:银,2.16g;
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为,n(e):n(Ag):n(O2):n(H2)=0.02:0.02:0.005:0.01=2:2:1/2:1;
故答案为:2:0.5:1;
(4)由Ag(阳)电极、Pt(阴)电极和AgNO3溶液组成的电镀池,因此AgNO3溶液浓度不变,pH也不变.电解5.00%的H2SO4溶液,由于其中的水发生电解,因此H2SO4溶液浓度增大,pH减小;
故答案为:不变,不变,增大,减小;
(5)设原5.00%的H2SO4溶液为xg,电解消耗水0.01×18=0.18g,则:5.00%x=5.02%(x﹣0.18),解得:x=45.18g.
故答案为:45.18;
点评: 本题考查电解原理的应用,主要是电解过程中电子守恒的计算应用,依据现象电极判断方法,题目难度中等.


科目:高中化学 来源: 题型:
对于2SO2(g)+O2(g)⇌2SO3(g)△H<0 反应来说:
(1)若将2mol SO2气体和1mol O2气体在2L容器中混合并在一定条件下发生反应,经2min建立平衡,此时测得SO3浓度为0.8mol•L﹣1,则从开始至2min用氧气表示的平均速率v(O2)= ;该条件时反应的平衡常数K= .
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有 (填字母).
A.升高温度B.降低温度C.增大压强 D.移出生成的SO3
(3)一定温度下,若将8mol SO2气体和4mol O2气体混合置于体积恒定的密闭容器中,能说明该反应已达到平衡状态的是 .
A.SO2的转化率和O2的转化率相等 B.容器内压强保持不变
C.v(SO2)逆=2v(O2)正 D.容器内密度保持不变
(4)一定温度下,将8mol SO2和4mol O2气体混合置于体积不变的密闭容器中,经t1时间达到平衡,测得混合气体总物质的量为10mol.若此时向容器中充入一定量的氦气,SO3(g)的物质的量将不变(填“增大”、“减小”或“不变”);若使SO2、O2、SO3三种气体均增加1mol,则平衡 (填“向左移动”、“向右移动”或“不移动”).
查看答案和解析>>
科目:高中化学 来源: 题型:
已知两个热化学方程式:
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol.
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是()
A. 1:1 B. 1:2 C. 2:3 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
电解CuCl2和NaCl的混合溶液,阴极和阳极上最先分别析出的物质是()
A. H2和Cl2 B. Cu和Cl2 C. H2和O2 D. Cu和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
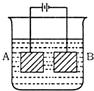
按图的装置进行电解,A极是铜锌含金,B极为纯铜.电解质溶液中含有足量的Cu2+.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A极合金中Cu、Zn的原子个数比为()
A. 4:1 B. 3:1 C. 2:1 D. 5:3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A. 由元素的原子序数推测其在元素周期表中的位置
B. 由H-H和Cl-Cl的键长推测液氢和液氯沸点的高低
C. 由CaF2晶体中,与Ca2+距离最近的F-有8个,推知与F-距离最近的Ca2+也有8个
D. 由N-N、H-H、N-H的键能数据估算3H2(g)+N2(g)  2NH3(g)的反应热
2NH3(g)的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
废水、废气、废渣的处理是减少污染、保护环境的重要措施。
(1)烟气中的NOx必须脱除(即脱硝)后才能排放。
①列举一种由NOx引起的大气污染现象: 。
②已知:CH4 (g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)=2NO(g);ΔH=+180 kJ·mol-1
则CH4脱硝的热化学方程式为CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l),ΔH=_____。
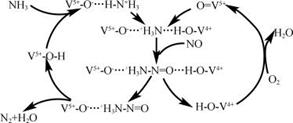
③下图是一种用NH3脱除烟气中NO的原理。该脱硝反应中,氧化剂是 ;
(2) 下图是一种三室微生物燃料电池污水净化系统原理示意图,同时处理有机废水和硝酸盐废水,并获得淡水。图中有机废水中有机物可用C6H10O5表示。
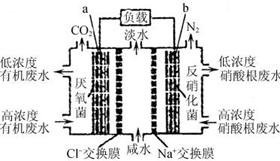
①电池正极为 。(填“a”或“b”)
②电极a上的电极反应式为 。
③电池工作过程中Na+离子移向 、Cl-离子移向 。(填“a电极”、或“b电极”)
④假设咸水中氯化钠的质量分数为2.34%,当两极总共产生7.84 L气体(标准状况下)时,理论上处理咸水 g。(忽略CO2的溶解)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com