
【题目】X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第__________周期,第____族;
(2)X可形成双原子分子,其分子的电子式是_____;Y和氢元素形成的10电子微粒中常见+1价阳离子为_____(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为______;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式______________________。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡时有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是_____________。
【答案】三VIIA![]() H3O+HS-2S2Cl2+2H2O═3S↓+SO2↑+4HCl2SO2(g)+O2(g)
H3O+HS-2S2Cl2+2H2O═3S↓+SO2↑+4HCl2SO2(g)+O2(g)![]() 2SO3(g) △H=-190.0 kJmol-1
2SO3(g) △H=-190.0 kJmol-1
【解析】
由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是其电子层数的3倍,最外层电子数为6,故Y为O元素,可推知X为N元素、Z为S元素、W为Cl;
(1)W为Cl元素,处于周期表中第三周期第ⅦA族;
(2)X为N元素,形成的双原子分子为N2,其电子式是![]() ;Y为O元素,和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+;Z为S元素,和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;Y为O元素,和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+;Z为S元素,和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
(3)化合物S2Cl2可与水反应生成一种能使品红溶液褪色的气体,该气体为SO2,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,故S元素化合价降低,转移0.3mol电子生成二氧化硫为0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl;
(4)在一定条件下,元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡时有三种气态物质,反应方程式为:2SO2+O22SO3,反应时每转移4mol电子放热190.0kJ,则参加反应二氧化硫为![]() =2mol,该反应的热化学方程式是:2SO2 (g)+O2(g)2SO3(g)△H=-190.0 kJmol-1。
=2mol,该反应的热化学方程式是:2SO2 (g)+O2(g)2SO3(g)△H=-190.0 kJmol-1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列拟采用的金属防腐措施,错误的是
A.给金属衣架或电线外面包上一层塑料层
B.给自行车钢圈镀上一层金属铬
C.将铁闸门与铜相连
D.给铁栅栏表面涂上一层油漆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质中不属于烷烃具有的性质的是( )
A. 完全燃烧产物只有CO2和H2O
B. 与卤素单质发生取代反应
C. 都溶于水
D. 通常不与强酸、强碱、强氧化剂反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子式为C5H10O,它能发生银镜反应和加成反应。若将其与H2加成,则所得产物的结构简式可能是( )
①(CH3CH2)2CHOH ②(CH3)3CCH2OH
③CH3CH2C(CH3)2OH ④CH3(CH2)3CH2OH
A. ①② B. ②④
C. ①④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是
A.c(CO32- ) B.c(Mg2+) C.c(H+) D.Ksp(MgCO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图中,A、B、C、D是氯气或含氯的化合物。
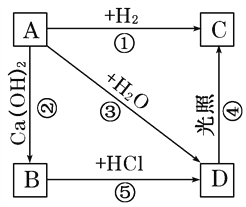
(1)推断(写化学式):
A____________________,
B____________________,
C____________________,
D____________________。
(2)写出①~⑤各步反应的化学方程式。
①______________________________,
②______________________________,
③______________________________,
④______________________________,
⑤______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质含有的氧原子数最多的是
A.32gO2和O3的混合气体
B.0.5molCuSO4·5H2O晶体
C.6.02×1023个CO2分子
D.1L1mol/L的稀H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:
CO(g)+2 H2(g) ![]() CH3OH(g)
CH3OH(g)

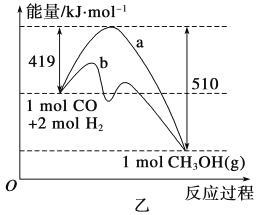
(1)甲图是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=_____________;
(2)乙图表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应的焓变是________(填“ΔH<0”或“ΔH>0”)反应,写出反应的热化学方程式:______ _;选择适宜的催化剂__________(填“能”或“不能”)改变该反应的反应热。
(3)恒容条件下,下列措施中能使![]() 增大的有____________。
增大的有____________。
a.升高温度 b.充入1mol He气
c.再充入1 mol CO和2 mol H2 d.使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com