
纳米级Fe粉是新型材料,具有超强磁性、高效催化性。某化学小组探究用氢气和碳酸亚铁制取纳米级铁粉。其实验设计如图(加热、支持装置省略)
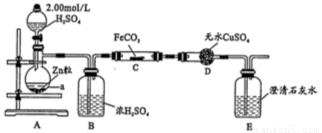
(1)a的名称是________________;浓硫酸的作用是________________。
(2)打开分液漏斗活塞,一段时间后再对C装置加热,这样操作的目的是_______________;反应一段时间后D中变蓝,E中溶液变浑浊,C中发生反应的化学方程式为______________。
(3)反应中若观察到B装置中气泡产生过快,则应进行的操作是_____________________。
(4)反应一段时间后,B中产生气泡太慢,再滴加硫酸反应速率略有加快但不明显;若向硫酸中加少量硫酸铜再滴入与Zn反应,反应速率明显加快,原因是____________________。
(5)检验碳酸亚铁中含有铁元素的实验方法是______________________。
科目:高中化学 来源:2017届内蒙古高三上9月月考化学卷(解析版) 题型:选择题
下列化工生产过程中,未涉及氧化还原反应的是( )
A.海带提碘 B.氯碱工业
C.氨碱法制碱 D.海水提溴
查看答案和解析>>
科目:高中化学 来源:2017届江苏省无锡市三校联合体高三上第一次月考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是

A. 离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B. 元素W的最高价氧化物对应水化物的酸性比Q的强
C. 元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
青蒿琥酯是治疗疟疾的首选药,可由青蒿素两步合成得到。下列有关说法不正确的是( )

A.青蒿素分子式为C15H22O5
B.青蒿素能与NaOH溶液反应
C.反应②原子利用率为100%
D.青蒿琥酯能与氢氧化钠溶液反应可生成青蒿琥酯钠
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
已知 ①同温度下的溶解度;Zn(OH)2 > ZnS,MgCO3 > Mg(OH)2;②溶解或电离出S2-的能力:FeS > H2S > CuS,则下列离子方程式错误的是( )
A.Mg2+ + 2HCO3-+ 2Ca2+ + 4OH- → Mg(OH)2↓+2CaCO3↓+2H2O
B.FeS + 2H+ → Fe2++ H2S↑
C.Cu2+ + H2S → CuS↓+ 2H+
D.Zn2+ + S2-+ 2H2O → Zn(OH)2↓+ H2S↑
查看答案和解析>>
科目:高中化学 来源:2017届四川省校高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.向硫酸铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO- 2+4NH+ 4+2H2O
B.少量双氧水滴入酸性KI溶液:2H2O2+2I-+4H+=4H2O+I2
C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO- 3=3Fe3++NO↑+2H2O
D.碱性锌锰电池正极反应:2MnO2+2H2O+2e-=2MnOOH+2OH-
查看答案和解析>>
科目:高中化学 来源:2017届湖南省实验班高三上第一次质检化学试卷(解析版) 题型:实验题
钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质)

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表.
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | ﹣0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式: .
(2)步骤Ⅲ中 Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过 ;废渣中的主要成分除了LiF外,还有 .
(3)NaF 与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是 .
(4)在空气中加热5.49g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.已知:M(CoC2O4·2H2O)=183g/mol
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是 .温度高于890℃时,固体产物发生分解反应,固体产物为 .
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期9月月考化学试卷(解析版) 题型:选择题
下列说法中正确的是( )
A.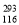 Lv的相对原子质量为293
Lv的相对原子质量为293
B.H2O的稳定性大于H2S ,是因为水分子间存在氢键
,是因为水分子间存在氢键
C.某物质中含有极性键,则该物质不可能是单质
D.元素的非金属性越强,其气态氢化物水溶液的酸性越强
查看答案和解析>>
科目:高中化学 来源:2017届浙江省绍兴市高三上学期适应性考试化学试卷(解析版) 题型:填空题
碳、硫和氮元素及其化合物的处理,是资源利用和环境保护的重要研究课题。
(1)CO可转化成二甲醚,原理为:2CO(g)+4H2(g)  CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
已知一定条件下,该反应中CO的平衡转化率随温度、投料比[n(H2)/n(CO)]的变化曲线

若温度升高,则反应的平衡常数K将 (填“增大”、“减小”或“不变”);
(2)SO2的水溶液呈酸性,某温度下,0.02mol·L-1亚硫酸水溶液的pH等于2,若忽略亚硫酸的二级电离和H2O的电离,则该温度下亚硫酸的一级电离常数Ka1= 。
(3)已知:反应1:2SO2(g)+O2(g)  2SO3(g) ΔH1;
2SO3(g) ΔH1;
反应2:2NO(g)+O2(g)  2NO2(g) ΔH2;
2NO2(g) ΔH2;
若ΔH1<ΔH2<0,则反应3:SO2(g)+NO2(g)  SO3(g)+NO(g)属于 (填“放热”或“吸热”)反应。
SO3(g)+NO(g)属于 (填“放热”或“吸热”)反应。
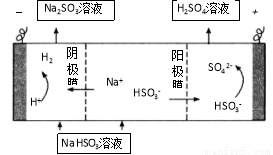
(4)若用少量NaOH溶液吸收SO2气体,对产物NaHSO3进一步电解可制得硫酸,电解原理示意图(见右图)。电解时阳极的电极反应式为 。
(5)在恒温密闭容器中通入SO2和NO2各1mol发生反应3:SO2(g)+NO2(g)  SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”);请在上图中画出正反应速率v正在10至30min间随时间变化的曲线图。
SO3(g)+NO(g),当反应达到平衡后,维持温度和容积不变,10min时再通入各1mol的SO2和NO2的混合气体,20min时再次平衡。两次平衡时NO2的转化率α1 α2(填“>”、“<”、“=”);请在上图中画出正反应速率v正在10至30min间随时间变化的曲线图。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com