
| A. | 标准状况下,22.4L H2O含有的分子数为1NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.2NA | |
| C. | 通常状况下,NA个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA |
分析 A.气体摩尔体积使用对象为气体;
B.依据n=$\frac{m}{M}$计算物质的量结合镁原子失去最外层电子计算
C.通常状况下,Vm≠22.4L/mol;
D.溶液体积未知.
解答 解:A.标况下,水是液态,不能使用气体摩尔体积,故A错误;
B.2.4g金属镁物质的量为0.1mol,镁原子最外层电子为2,变为镁离子时失去的电子数为0.2 NA,故B正确;
C.通常状况下,Vm≠22.4L/mol,NA个CO2分子占有的体积不等于22.4L,故C错误;
D.溶液体积未知,无法计算氯离子个数,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是质量换算物质的量计算微粒数,气体摩尔体积的条件应用,掌握基础是关键,题目较简单.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
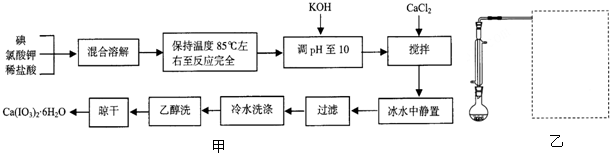
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 味觉上有酸味的食物即酸性食物 | |
| B. | 生石灰可防止食物受潮,铁粉可防止食物氧化变质 | |
| C. | 油脂、淀粉、蛋白质和维生素等均为高分子化合物 | |
| D. | 食品添加剂苯甲酸钠是有毒,所以应该禁止添加食品添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2F2+2H2O═4HF+O2 | B. | H2O+CO2═H2CO3 | ||
| C. | Cl2+H2O═HClO+HCl | D. | 2H2O═2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L NH3所含的原子数为2NA | |
| B. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L H2中所含原子数为NA | |
| D. | 56gCO所含的分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 实验室中进行可燃性气体燃烧性质实验时,必须先验纯,后点燃 | |
| D. | 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥⑧ | B. | ①②④⑤⑥⑦⑧ | C. | ①③④⑤⑥⑨ | D. | ①④⑤⑥⑦⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com