
| A. | 3:1 | B. | 4:1 | C. | 3:2 | D. | 7:2 |
分析 将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,沉淀为Al(OH)3,溶液中的铝可能为AlCl3或NaAlO2,
可分别发生:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,结合反应的离子方程式分为两种情况讨论计算.
解答 解:设AlCl3和NaOH的浓度分别为c1和c2,相同体积为V,
若NaOH过量,生成NaAlO2,此时参加反应的AlCl3的物质的量是c1Vmol,NaOH是3c1Vmol,生成c1V mol 的Al(OH)3,
又因为得到的沉淀物中铝元素的质量和溶液中铝元素的质量相等,则说明第一步反应完后,生成的Al(OH)3有一半($\frac{1}{2}$c1V)发生Al(OH)3+OH-=AlO2-+2H2O,
所以可求的NaOH的物质的量为:3c1V+0.5c1V=3.5c1V=c2V,所以c1:c2=2:7,D选项符合;
当氯化铝过量时,氢氧化钠不足,生成氢氧化铝白色沉淀发生反应:Al3++3OH-═Al(OH)3↓,设反应掉的铝离子物质的量为x,得到的沉淀物中铝元素的质量和溶液中铝元素的质量相等,则c1V-x=x,所以x=0.5c1V,消耗氢氧化钠3x,即1.5c1Vmol,所以1.5c1V=c2V,所以此时c1:c2=2:3,C选项符合;
故选CD.
点评 本题考查物质的量浓度、离子反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | R元素的氢化物常温下可能为液态 | |
| B. | R一定是第ⅣA族元素 | |
| C. | R的气态氢化物化学式为H2R | |
| D. | R元素的气态氢化物比同周期其他元素的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:4 | B. | 1:2 | C. | 1:4 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
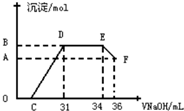 研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )
研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )| A. | 图中OC段的离子方程式为:NH4++OH-═NH3•H2O | |
| B. | 在DE段的离子方程式为:H++OH-═H2O | |
| C. | B与A的差值为 0.002mol | |
| D. | C点对应的氢氧化钠溶液的体积为7 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | NH3 | C. | CO2 | D. | FeCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com