
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中________________能导致酸雨的形成;目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。
如:CO(g)+NO2(g)![]() NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
据此回答:若用标准状况下
(2)在火力发电厂产生的废气中含有SO2、N2、CO等气体,为除去SO2,常用Ca(OH)2悬浊液洗涤废气,为了废物利用,再通入空气使反应产物转化为石膏(CaSO4·2H2O)。写出有关的化学反应方程式______________。
(3)硫酸工业生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ·mol-1
2SO3(g) ΔH=-196 kJ·mol-1

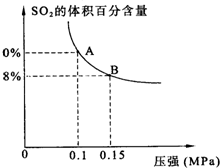
某温度下达到平衡时,SO2的体积百分含量与体系的总压强的关系如上图所示:
据此图回答下列问题:
①平衡状态由A变到B时,反应体系____________(填“吸收”或“释放”)能量。
②将5 mol SO2和7 mol O2通入
(1)NO2、SO2 0.3 3(
(2)SO2+Ca(OH)2![]() CaSO3↓+H2O;
CaSO3↓+H2O;
2CaSO3+O2+4H2O![]() 2CaSO4·2H2O
2CaSO4·2H2O
(3)①释放 ②32(mol·L-1)-1
解析:(1)NOx与SOx形成酸雨,即SO2和NO2;
n(e-)=![]() ×2=0.3 mol
×2=0.3 mol
①×2+②得
4CO(g)+2NO2![]() N2+4CO2 ΔH=
N2+4CO2 ΔH=
4 mol
0.15 mol x
x=![]() kJ·mol-1=
kJ·mol-1=![]() kJ·mol-1,
kJ·mol-1,
故放热![]() (
(
(2)SO2+Ca(OH)2![]() CaSO3↓+H2O
CaSO3↓+H2O
2CaSO3+O2+4H2O![]() 2CaSO4·2H2O
2CaSO4·2H2O
(3)①由A变到B,平衡右移,释放能量。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:阅读理解
 二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.| 3(2a+b) |
| 80 |
| 3(2a+b) |
| 80 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| V(臭氧空气) | V(烟气) |
查看答案和解析>>
科目:高中化学 来源:2010年沙河一中考前预测卷化学试题 题型:填空题
(13分)二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中 能导致光化学烟雾的形成;
目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。如:CO(g)+NO2(g) NO(g)+CO2(g) △H=-akJ·mol—1(a>0)2CO(g)+2NO2(g) N2(g)+2CO2(g) △H=-bkJ·mol—1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,SO2(g)+1/2O2(g)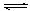 SO3(g);△H=" —98" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
SO3(g);△H=" —98" kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= 。
②一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)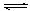 2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
A.保持温度和容器压强不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
E.升高温度 F.移动活塞压缩气体
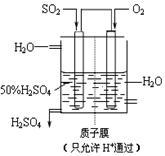
(4)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省九江市高三2月七校联考(理综)化学部分 题型:填空题
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1) 新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,其吸收的化学反应方程式为 再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(2) 工业上生产硫酸时,将SO2氧化为SO3是关键一步。
① 某温度下,SO2(g)+1/2O2(g) SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K=
。
SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K=
。
② 一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件,SO3的体积分数变大的是
2SO3(g)达到平衡后改变下述条件,SO3的体积分数变大的是
A、保持温度和容器压强不变,充入2mol SO3
B、保持温度和容器体积不变,充入2mol N2
C、保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
D、升高温度
E、移动活塞压缩气体
(3) 某人设想以如图所示装置用电化学原理生产硫酸,通入O2的一极的电极为 极; 写出通入SO2的电极的电极反应式: 。
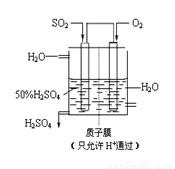
查看答案和解析>>
科目:高中化学 来源:2010年沙河一中考前预测卷化学试题 题型:填空题
(13分)二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一。
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中 能导致光化学烟雾的形成;
目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。如:CO(g)+NO2(g) NO(g)+CO2(g)
△H=-akJ·mol—1(a>0)2CO(g)+2NO2(g) N2(g)+2CO2(g)
△H=-bkJ·mol—1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为 mol,放出的热量为 kJ(用含有a和b的代数式表示)。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (只要求写一种)。
(3)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
①某温度下,SO2(g)+1/2O2(g) SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=
。
SO3(g);△H= —98 kJ· mol—1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=
。
②一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
2SO3(g)达到平衡后改变下述条件SO3 的体积分数变大的是
A.保持温度和容器压强不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
E.升高温度 F.移动活塞压缩气体
(4)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
。
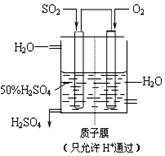
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com