
| A. | SiH4分子呈正四面体形 | |
| B. | SiH4分子是非极性分子 | |
| C. | 因为Si-H键键能比C-H键键能低,所以SiH4沸点低于CH4沸点 | |
| D. | SiH4分子稳定性低于CH4分子,因为C-H键键能高 |
分析 A、甲烷分子为正四面体构型,SiH4的分子结构与CH4类似;
B、正负电荷中心对称;
C、结构相似的分子晶体,相对分子量越大沸点越高;
D、中心元素的非金属性越强对应氢化物越稳定.
解答 解:A、甲烷分子为正四面体构型,SiH4的分子结构与CH4类似,因此SiH4具有正四面体的构型,故A正确;
B、SiH4正四面体的构型,正负电荷中心对称是正四面体结构,所以是非极性分子,故B正确;
C、结构相似的分子晶体,相对分子量越大沸点越高,所以SiH4沸点高于CH4沸点,故C错误;
D、中心元素的非金属性越强对应氢化物越稳定,因为碳的非金属性强于硅,则C-H键键能高,所以CH4分子稳定,故D正确;
故选C.
点评 本题考查了物质的结构和性质,采用类比法分析,题目难度不大,注意掌握利用电负性的差异去判断共价键的极性强弱.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验室所制得的1.7gNH3中含有的电子数为0.1NA | |
| B. | 标准状况下2.24LHF中含有HF分子数为0.1NA | |
| C. | 1L0.1 mol•L-1NaHSO4溶液中含有的阳离子数目为0.1NA | |
| D. | 0.1mol氯酸钾与足量盐酸反应生成氯气转移电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
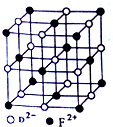 已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:
已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||||
| Y | Z | W |
| A. | X分别与Y、Z形成的化合物中化学键类型相同 | |
| B. | Z的最高价氧化物的水化物酸性比W的强 | |
| C. | X的简单气态氢化物的稳定性比W的弱 | |
| D. | 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$═10-10mol/L的溶液中:Na+、HCO3-、Cl-、K+ | |
| C. | 在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3- | |
| D. | 由水电离产生的c(OH-)=1×10-12mol/L的溶液中:NO3-、Mg2+、Na+、SO42 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓烧碱溶液中加入铝片:A1+2OH-+2H2O═[A1(OH)4]-+H2↑ | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3一═CaCO3↓+H2O | |
| C. | 食醋和小苏打溶液混合;CH3COOH+HCO3一═CH3COO-十H2O+CO2↑ | |
| D. | 敞开体系,向FeC12溶液滴加NaOH溶液:4Fe2++8OH-+O2+2H2O═4Fe (OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、AlO2-、Cl-、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ca2+、Fe2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、HSO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
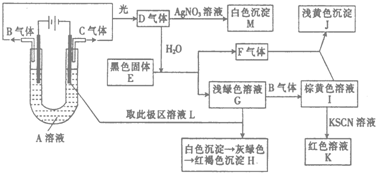
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com