
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)浓度为0.1mol/L的8种溶液:①HNO3 ②H2SO4 ③HCOOH ④Ba(OH)2 ⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl 溶液pH值由小到大的顺序是(填写编号)____________。
(2)B为0.1molL-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请用离子方程式表示其原因:___________________。
(3)在0.10 molL-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=___________(已知Ksp[Cu(OH) 2]=2.2x10-20)。若在0.10 molL-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是________。
【答案】(1)②①③⑧⑦⑥⑤④
(2)HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
(3)2.2x10-8mol·L-1;0.2mol·L-1
【解析】
试题分析:(1)①②③属于酸,硝酸是一元强酸、硫酸是二元强酸、醋酸是一元弱酸,所以相同浓度时氢离子浓度大小顺序是②>①>③,所以酸溶液pH大小顺序是③>①>②;④⑤属于碱,氢氧化钡是二元强碱、NaOH是一元强碱,所以氢氧化钡中氢氧根离子浓度大于NaOH,则溶液pH大小顺序是④>⑤;⑥⑦⑧属于盐,醋酸钠是强碱弱酸盐,其溶液呈碱性,氯化钾是强酸强碱盐,其溶液呈中性,氯化铵是强酸弱碱盐,其溶液呈酸性,所以相同浓度的这三种盐pH大小顺序是⑥>⑦>⑧;相同浓度时,pH大小顺序是碱>盐>酸,通过以上分析知,相同浓度的这几种溶液pH从小到大顺序是②①③⑧⑦⑥⑤④,故答案为:②①③⑧⑦⑥⑤④;
(2)在NaHCO3溶液中存在碳酸氢根离子的水解平衡为:HCO3+H2O![]() H2CO3+OH-,电离平衡为:HCO3-
H2CO3+OH-,电离平衡为:HCO3-![]() H++CO32-;而以水解为主,即碳酸氢根离子的水解程度大于电离程度溶液,故显碱性;故答案为:HCO3+H2O
H++CO32-;而以水解为主,即碳酸氢根离子的水解程度大于电离程度溶液,故显碱性;故答案为:HCO3+H2O![]() H2CO3+OH-;
H2CO3+OH-;
(3)根据题给Cu(OH)2的溶度积即可确定pH=8时,c(OH-)=10-6mol/L,Ksp[Cu(OH)2]=2.2×10-20,则:c(Cu2+)=![]() =2.2×10-8molL-1;在0.1molL-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42-)不变,为0.1molL-1,由电荷守恒可知c(H+)为0.2molL-1,故答案为:2.2×10-8 molL-1;0.2 molL-1。
=2.2×10-8molL-1;在0.1molL-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42-)不变,为0.1molL-1,由电荷守恒可知c(H+)为0.2molL-1,故答案为:2.2×10-8 molL-1;0.2 molL-1。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】下列物质之间的关系,错误的是:
A.CH3CH2OH和CH3OCH3互为同分异构体
B.干冰和冰为同一种物质
C.O2和O3互为同素异形体
D.CH3CH3和CH3CH2CH3互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是
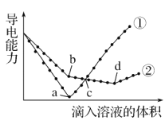
A.b点,水电离产生的c(H+)< 10-7 mol/L B.①代表滴加H2SO4溶液的变化曲线
C.a、d两点对应的溶液均显中性 D.c点,两溶液中含有相同量的 OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是

A.浓H2SO4 B.浓盐酸 C.NaOH溶液 D.饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。下列说法正确的是

A. I图中:如果MnO2过量,浓盐酸就可全部消耗
B. II图中:如果倒置的最筒充满了氯气,水槽内装满水经足够长的时间光照,量筒内最后剩余气体为HCl和氧气
C. III图中:生成蓝色的烟
D. IV图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中至溶液显酸性结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=1的无色溶液中,下列离子能大量共存的是
A.NH4+、Ba2+、NO3-、CO32-
B.Fe2+、OH-、SO42-、MnO4-
C.K+、Mg2+、NO3-、SO42-
D.Na+、Fe3+、Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【江苏省联盟大联考2017届高三2月联考】下列说法正确的是( )
A. 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0
B. 0.1mol/L氨水加水稀释后,溶液中![]() 的值减小
的值减小
C. 常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D. 合成氨时,其他条件不变,升高温度,氢气的反应速率和平衡转化率均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000mol·L-1盐酸滴入20.00ml1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )

A.a点由水电离出的c(H+)=1.0×10-14molL-1
B.b点:c(NH4+)+c(NH3H2O)=c(Cl-)
C.c点:c(Cl-)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家发明的水溶液锂电池为电动汽车发展扫除了障碍,装置原理如下图所示,其中固体薄膜只允许Li+通过。锂离子电池的总反应为xLi +Li1-xMn2O4![]() LiMn2O4,下列有关说法错误的是
LiMn2O4,下列有关说法错误的是

A. 放电时,Li+穿过固体薄膜进入到水溶液电解质中
B. 放电时,正极反应为Li1-xMn2O4+xLi++xe-![]() LiMn2O4
LiMn2O4
C. 该电池的缺点是存在副反应:2Li +2H2O![]() 2LiOH+H2↑
2LiOH+H2↑
D. 充电时,电极b为阳极,发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com