
对下列化学反应从不同的角度进行分类:
①碳在氧气中燃烧;②硫在氧气中燃烧;③铁丝在氧气中燃烧;④铝粉在氧气中燃烧;⑤蜡烛在氧气中燃烧。
分类标准1:是不是化合反应。反应①②③④是一类,都是化合反应;反应⑤为一类。分类标准2:反应物的特点。反应①②为一类,都是非金属跟氧气反应,反应③④为一类,都是金属跟氧气反应,反应⑤为一类;分类标准3:反应物的特点。反应①②③④为一类,都是无机物(或单质)跟氧气反应,反应⑤为一类;……
本题能力层次为C。根据反应的特点及反应物质的类别等进行分类。分类法是学习科学知识和从事科学研究行之有效、简单易行的科学方法。对给定的物质、反应等,根据需要可以有不同的分类方法,如交叉分类法、树状分类法等。对物质或反应进行分类时,关键是选择分类的“标准”,标准的选择是否恰当取决于对物质或反应的认识是否正确和全面。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| Cu2O |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

查看答案和解析>>
科目:高中化学 来源: 题型:
问题1:从不同的角度,化学反应可以有不同的分类方法。请在下方的方框中,用图示的方法表示离子反应、化合反应和氧化还原反应之间的关系(每类反应各用一个圆圈表示)。

问题2:化学反应的发生是有条件的。反应物相同,反应条件不同,产物不同(列举一例,用化学方程式表示,下同):____________________________________________________、___________________________________________________________________。
问题3:得到同样产物的途径是多样的。反应物不同,反应条件相同,产物相同:_____________________________________________________________________、_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
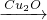 2H2(g)+O2(g)△H=+484kJ?mol-1不同时段产生O2的量见下表:
2H2(g)+O2(g)△H=+484kJ?mol-1不同时段产生O2的量见下表:| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com