
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C 计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
Ⅰ C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及到的反应为:
Ⅳ C(s)+O2(g)=CO2
Ⅴ CaCO3(s)=CaO(s)+CO2(g)
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),其反应的平衡常数K=_________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________。
CaCO3(s)+2H2(g),其反应的平衡常数K=_________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________。
A.容器内压强不再变化 B.H2与H2O(g)的物质的量之比不再交化
C.混合气体的密度不再变化 D.形成amolH-H键的同时断裂 2amolH-O键
(2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
压强 温度 | p1/Mpa | p2/Mpa |
500℃ | 45.6% | 51.3% |
700℃ | 67.8% | 71.6% |
下列图像正确的是_________。

(3)已知反应Ⅱ的△H=-41.1kJ/mol, C=O、O-H、H-H的键能分别为803KJ/mol,464 kJ/mol、436kJ/mol,则 CO中碳氧键的键能为_________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为_________;当重新平衡后,CO2浓度_________(填“变大”“变小”“不变”)。
(5)氢镍电池具有无记忆、无污染,免维护等特点,被称为绿色电池。该电池的总反应为:H+NiOOH![]() M+Ni(OH)2,其中M为储氢合金材料,则充电过程中的阴极反应式为_______________。
M+Ni(OH)2,其中M为储氢合金材料,则充电过程中的阴极反应式为_______________。
【答案】 K1·K2·K3 BC BD 1072.9 正向移动或向右移动 不变 M+H2O +e-= MH+OH-
【解析】(1)①由盖斯定律知反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H等于反应I、Ⅱ、Ⅲ的△H之和,则平衡常数K等于I、Ⅱ、Ⅲ的K之积,即K=K1K2K3;A.混合气体的物质的量始终不变,恒温恒容时容器内压强始终不变,无法判断是平衡状态,故A错误;B.H2与H2O(g)的物质的量之比不再交化,说明量一定,是平衡状态,故B正确;C.体积一定,混合气体的质量不确定,当混合气体的密度不再变化时,是平衡状态,故C正确;D.形成amolH-H键的同时断裂 2amolH-O键,均为逆反应,无法判断是平衡状态,故D错误;答案为BC;
CaCO3(s)+2H2(g)的△H等于反应I、Ⅱ、Ⅲ的△H之和,则平衡常数K等于I、Ⅱ、Ⅲ的K之积,即K=K1K2K3;A.混合气体的物质的量始终不变,恒温恒容时容器内压强始终不变,无法判断是平衡状态,故A错误;B.H2与H2O(g)的物质的量之比不再交化,说明量一定,是平衡状态,故B正确;C.体积一定,混合气体的质量不确定,当混合气体的密度不再变化时,是平衡状态,故C正确;D.形成amolH-H键的同时断裂 2amolH-O键,均为逆反应,无法判断是平衡状态,故D错误;答案为BC;
(2)对于可逆反应C(s)+H2O(g)![]() CO(g)+H2(g) 温度不变,增加压强平衡逆向移动,则H2的产率降低,则p1>p2,压强不变时,升高温度,H2的产率增大,说明正反应为吸热反应;A.由p1到p2降低压强,反应速率降低,平衡应正向移动,故A错误;B.图像符合升高温度平衡正向移动,且H2的产率增大,故B正确;C.恒压下,升高温度平衡正向移动,H2O的含量降低,但恒温下,增大压强平衡逆向移动,H2O的含量增加,故C错误;D.温度升高,平衡正向移动,平衡常数增加,故D正确;答案为BD;
CO(g)+H2(g) 温度不变,增加压强平衡逆向移动,则H2的产率降低,则p1>p2,压强不变时,升高温度,H2的产率增大,说明正反应为吸热反应;A.由p1到p2降低压强,反应速率降低,平衡应正向移动,故A错误;B.图像符合升高温度平衡正向移动,且H2的产率增大,故B正确;C.恒压下,升高温度平衡正向移动,H2O的含量降低,但恒温下,增大压强平衡逆向移动,H2O的含量增加,故C错误;D.温度升高,平衡正向移动,平衡常数增加,故D正确;答案为BD;
(3)CO中碳氧键的键能为xKJ/mol,则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的△H=(x+2×464)KJ/mol-(2×803+436)KJ/mol=-41.1KJ/mol,解得:x=1072.9,即CO中碳氧键的键能为1072.9KJ/mol;
CO2(g)+H2(g)的△H=(x+2×464)KJ/mol-(2×803+436)KJ/mol=-41.1KJ/mol,解得:x=1072.9,即CO中碳氧键的键能为1072.9KJ/mol;
(4)对于反应CaO(s)+CO2(g)![]() CaCO3(s),若平衡时再充入CO2,增大反应物的浓度,则平衡移动方向为正向移动;当重新平衡后,因温度不变,平衡常数不变,则平衡时CO2浓度不变;
CaCO3(s),若平衡时再充入CO2,增大反应物的浓度,则平衡移动方向为正向移动;当重新平衡后,因温度不变,平衡常数不变,则平衡时CO2浓度不变;
(5)阴极上H2O得电子生成MH,则充电过程中阴极的电极反应式:H2O+M+e一=MH+OH-。


科目:高中化学 来源: 题型:
【题目】下列所示的图像能反映相对应实验的是

A.向pH=13的NaOH溶液中不断加水稀释
B.向碳酸氢钠溶液中逐滴加入稀盐酸至过量
C.将60℃接近饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D.将足量的金属镁片和锌片分别和等质量、相同质量分数的稀硫酸混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,电池反应为:2Na+xS=Na2Sx,电池结构如图所示。下列说法不正确的是( )

A. 放电时,Na作负极,反应式为Na-e-=Na+ B. 钠硫电池在常温下也能正常工作
C. 放电时Na+向正极移动 D. 当外电路通过0.25mol电子时消耗16g硫,则x=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M、N、Q的转化关系为,下列说法正确的是( )
![]()
A. M至N的反应类型是取代反应 B. N的同分异构体有6种
C. 可用酸性KMnO4溶液区分N与Q D. 0.3molQ与足量金属钠反应生成0.15NA个H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 化合反应都是放热反应
B. 在化学反应中形成新化学键时要吸收能量
C. 可以通过改变温度控制化学反应的限度
D. 决定化学反应速率的因素是反应物的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和氮氧化物的转化和综合利用既有利于节约资源,又有利于保护环境。
(1)H2还原法是处理燃煤烟气中SO2的方法之一。已知:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol—1
H2S(g)=H2(g)+S(s) ΔH=b kJ·mol—1
H2O(l)=H2O(g) ΔH=c kJ·mol—1
写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:____________。
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图所示。

①图中A点时,SO2的转化率为____________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)______vA(逆)(填“>”、“<”或“=”)。
③图中B点的压强平衡常数Kp=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图Ⅰ、Ⅱ所示。

①由图I知,当废气中的NO含量增加时,宜选用_________法提高脱氮效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为____________。
⑷研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。
①写出废气中的SO2与NaClO2反应的离子方程式:____________________________。
②温度高于60℃后,NO去除率随温度升高而下降的原因为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色溶液,可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH![]() 、K+、CO
、K+、CO![]() 、SO
、SO![]() 等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:

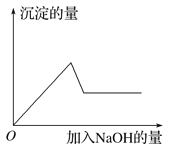
在第③个实验中,生成白色沉淀的量与加入NaOH的量有右图所示的相互关系。据此可知:
(1)在原溶液中一定不存在的离子有_______________________________________________。
(2)为满足该溶液中一定存在的离子的要求,一般可溶解两种常见物质为(写化学式)________和____________。
(3)写出第③个实验中发生反应的离子方程式:_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com