
| A. | H2SO4的摩尔质量是98 | |
| B. | 2 mol NO中含2 mol氮和2 molO | |
| C. | 等质量的O2和O3中所含氧原子个数相同 | |
| D. | 1 mol O2的体积是22.4L |
分析 A.摩尔质量的单位是g/mol,在数值上等于其相对分子质量;
B.指代不明确;
C.O2和O3是同素异形体,根据N(O)=$\frac{m(O)}{M(O)}{N}_{A}$计算O原子个数;
D.气体摩尔体积受温度和压强影响,温度、压强未知导致气体摩尔体积未知.
解答 解:A.摩尔质量的单位是g/mol,在数值上等于其相对分子质量,H2SO4的摩尔质量是98g/mol,故A错误;
B.氮指氮原子还是氮气分子,指代不明确,故B错误;
C.O2和O3是同素异形体,根据N(O)=$\frac{m(O)}{M(O)}{N}_{A}$知,氧原子质量、摩尔质量都相等,所以氧原子的物质的量相等,其原子个数相等,故C正确;
D.气体摩尔体积受温度和压强影响,温度、压强未知导致气体摩尔体积未知,所以无法计算氧气体积,故D错误;
故选C.
点评 本题考查物质的量的有关计算,为高频考点,注意气体摩尔体积适用范围和适用条件,易错选项是CD.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | W | X | Y | Z | 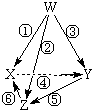 |
| A | N2 | NH3 | NO | NO2 | |
| B | Na | Na2O2 | NaOH | Na2CO3 | |
| C | Cu | CuSO4 | CuCl2 | Cu(OH)2 | |
| D | Al | Al2(SO4)3 | AlCl3 | NaAlO2 |
| A. | N2 NH3 NO NO2 | B. | Na Na2O2 NaOH Na2CO3 | ||
| C. | Cu CuSO4 CuCl2 Cu(OH)2 | D. | Al Al2(SO4)3 AlCl3 NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
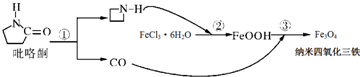
| A. | Fe3O4可以表示为FeO•Fe2O3,属于混合物 | |
| B. | 在反应②中FeCl3•6H2O被环丙胺(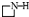 )还原为FeOOH )还原为FeOOH | |
| C. | 纳米四氧化三铁材料为胶体 | |
| D. | 反应③的化学方程式是:6FeOOH+CO═2Fe3O4+3H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应是置换反应,反应中有2个电子转移 | |
| B. | 反应是复分解反应 | |
| C. | 反应是氧化还原反应,反应中电子转移数为1 | |
| D. | 反应的离子方程式为H-+H+═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸氢钠溶液中加入足量烧碱溶液:HSO4-+OH-═SO42-+H2O | |
| C. | Ba(OH)2与H2SO4反应到恰好沉淀完全:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| D. | 向澄清的石灰水中滴入少量碳酸氢钠溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有电子得失或偏移 | B. | 氧化反应一定先于还原反应 | ||
| C. | 氧化剂发生氧化反应 | D. | 其实质是元素化合价发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com