
【题目】硫氰酸盐在化学工业中有广泛的应用。如 NH4SCN在有机工业用于聚合反应的催化剂,医药工业用于抗生素生产,印染工业用作印染扩散剂等。Co(SCN)2可以用来检验可卡因的存在。
(1)Co(SCN)2可以用CoSO4(aq)+Ba(SCN)2(aq)=BaSO4(s)+Co(SCN)2(aq)来制备,也可用CoCO3与足量HSCN制备,请写出反应方程式___________。
(2)某小组为探究NH4SCN的热分解产物,按如图所示装置进行实验。

①图中盛放NH4SCN的装置名称是___________,通入氮气的作用___________。
②反应一段时间后,发现B瓶中溶液分层,分液后取下层液体,该液体可将硫磺溶解,由此判断分解产物中有___________。
③D瓶中的石蕊溶液由紫色变为蓝色,证明分解产物生成___________,C瓶装置的作用___________。
④反应完成后,取一定量B瓶上层溶液用盐酸酸化,然后滴入到0.1mol·L-1CuSO4溶液中,立即析出黑色沉淀,请写该反应的离子方程式___________。
⑤某同学指出该实验装置存在不足,请写出改进措施___________。
【答案】2HSCN+CoCO3=Co(SCN)2+H2O+CO2↑ 硬质玻璃管 防止空气(或氧)干扰实验结果 二硫化碳 氨气 防石蕊溶液倒吸 Cu2++H2S=CuS↓+2H+ 在D装置后面添加尾气吸收装置
【解析】
(1)CoCO3和HSCN的反应,类似于CaCO3和HCl的反应,复分解反应,答案为2HSCN+CoCO3=Co(SCN)2+H2O+CO2↑;
(2) ① ![]() ,图中的装置为硬质玻璃管。该小组要探究NH4SCN的热分解产物,那么要防止物质与氧气反应,通入N2,排除装置中的氧气,防止其干扰试验,答案为硬质玻璃管 防止空气(或氧)干扰实验结果;
,图中的装置为硬质玻璃管。该小组要探究NH4SCN的热分解产物,那么要防止物质与氧气反应,通入N2,排除装置中的氧气,防止其干扰试验,答案为硬质玻璃管 防止空气(或氧)干扰实验结果;
②根据S难溶于水、微溶于酒精、易溶于CS2,而下层液体可以溶解硫磺,可以知道产物中有CS2,答案为CS2;
③D瓶中的石蕊溶液由紫色变为蓝色,通入了碱性气体,高中阶段的碱性气体只有氨气。氨气极易溶于水,C装置为了防止D中的石蕊溶液进入C中,答案为氨气 防石蕊溶液倒吸;
④滴加硫酸铜溶液,产生黑色沉淀,根据原子守恒,为CuS。用盐酸酸化后,溶液中S2-存在形式为H2S,答案为Cu2++H2S=CuS↓+2H+;
⑤根据前面的过程知道,分解产物中有氨气生成,需要进行尾气处理,答案为在D装置后面添加尾气吸收装置。


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
我国科学家在合成、生产生物医用材料——新型增塑剂(DEHCH)方面获得重要进展,该增塑剂可由有机物D和L制备,其结构简式如下:

(1)有机物D的一种合成路线如下:

已知:
(R、R表示烃基或氢)
①由C2H4生成A的化学方程式是________。
②试剂a是________
③写出B中所含官能团的名称________。
④有机物D的结构简式是________。
(2)增塑剂(DEHCH)的合成路线如下:
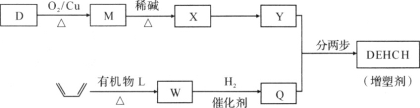
已知:
⑤D→M的化学方程式是________。
⑥有机物L的分子式为C4H2O3,核磁共振氢谱显示只有一种化学环境的氢原子。W的结构简式是________。
⑦以Y和Q为原料合成DEHCH分为两步反应,写出有关化合物的结构简式:

中间产物的结构简式是________,反应a的反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴、 铜及其化合物在工业上有重要用途, 回答下列问题:
(1) 请补充完基态Co的简化电子排布式: [Ar]_________, Co2+有_______个未成对电子。
(2) Na3[Co(NO2)6]常用作检验K+的试剂, 配位体NO2-的中心原子的杂化形式为________, 空间构型为_____。大π键可用符号![]() 表示, 其中m代表参与形成大π键的原子数, n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为
表示, 其中m代表参与形成大π键的原子数, n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和 (如苯分子中的大π键可表示为![]() ),则NO2-中大π键应表示为____________。
),则NO2-中大π键应表示为____________。
(3) 配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ), 是铜的一种重要化合物。其中 En 是乙二胺(H2NCH2CH2NH2)的简写。
①该配合物[Cu(En)2]SO4中N、 O、 Cu的第一电离能由小到大的顺序是______________。
②乙二胺和三甲胺[N(CH3)3]均属于胺, 且相对分子质量相近, 但乙二胺比三甲胺的沸点高得多, 原因是______________________________________________________。

(4) 金属Cu晶体中的原子堆积方式如图所示, 其配位数为______, 铜的原子半径为a nm, 阿伏加德罗常数的值为NA, Cu的密度为_________g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在常温下,有硫酸和盐酸的混合液20 mL,向该溶液中加入0.05 mol/L的Ba(OH)2时,生成的BaSO4沉淀的质量和混合溶液的pH有如图所示关系。计算:

①最初混合溶液中硫酸和盐酸的物质的量浓度。_____________
②A点溶液的pH值。_________________
(2)某温度时,Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,试求:
①在该某温度时AgCl的溶解度;(![]() =1.34,结果保留一位有效数字)_______________
=1.34,结果保留一位有效数字)_______________
②若把足量的AgCl固体分别放入①100 mL H2O ②100 mL 0.1 mol/L NaCl溶液 ③100 mL 0.1 mol/L AlCl3溶液 ④100 mL 0.1 mol/L MgCl2溶液,搅拌后溶解达到平衡,在相同温度下,求各溶液中Ag+浓度由大到小的顺序。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 常温常压下,11.2L二氧化硫所含的氧原子数等于NA
B. 0.5molH2O所含的电子数为9NA
C. 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA
D. 300mL2mol·L-1蔗糖溶液中所含分子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排措施是我国“十一五”期间提出的政策措施。
(1)煤的燃烧,会产生大量有害气体。将煤转化为水煤气,可有效降低排放。
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式___________。
(2)汽车尾气的排放是大气污染物的重要来源,其中含有NO气体。根据资料显示用活性炭还原法可以处理氮氧化物,某硏究小组向固定容积的密闭容器中加入一定量的活性炭和NO发生反应C(s)+2NO(g)![]() CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:

①0到10min内,NO的平均反应速率v(NO)=___________mol·L-1·min-1。
②下列数据不再变化可表示该反应达到平衡的是___________。
a.容器内压强 b.混合气体的平均摩尔质量 c.混合气体的密度
③若容器改为可变容积容器,达平衡后改变某一条件,一段时间后,反应再次达到原平衡,请写出可能改变的条件是___________(任写一种)。
(3)在某温度T时能同时发生反应:
2N2O5(g)![]() 2N2O4(g)+O2(g) K1
2N2O4(g)+O2(g) K1
N2O4(g)![]() 2NO2(g) K2
2NO2(g) K2
若向一体积固定为2L的密闭容器内加入N2O52mol,一段时间后,容器内的反应达到平衡,此时n(NO2)=0.4mol,已知K2=0.1,请计算出K1=___________。
(4)一定条件下,将汽车尾气通入到氢氧化钠溶液,尾气中氮的氧化物可以转化为亚硝酸钠,工业上可以用亚硝酸钠来制备亚硝酸。已知,25℃时亚硝酸(HNO2)、亚硫酸(H2SO3)的电离平衡常数分别如下:
Ka1 | Ka2 | |
亚硝酸(HNO2) | 7.1×10-4 | |
亚硫酸(H2SO3) | 1.54×10-2 | 1.02×10-7 |
请回答下列问题
①常温下,将0.1mol·L-1的亚硝酸稀释100倍,c(H+)将___________(填“不变”、增大”、“减小”);Ka值将(填“不变”、“增大”、“减小”)___________。
②下列离子方程式能发生的是___________(填字母)。
a.NO2-+SO2+H2O=HNO2 +HSO3- b. 2HNO2+SO32-=2NO2-+SO2↑+H2O
c.2NO2-+SO2 +H2O=2HNO2 +SO32- d. HNO2+SO32-= NO2-+ HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活应用实例中,涉及氧化还原反应的是
A. 用白醋去除水垢
B. 用热的纯碱溶液清洗油污
C. 用风油精(含石蜡油)清洗透明胶残胶
D. 补铁剂(有效成分为Fe2+)与含维生素C共服效果更佳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对硫酸亚铁的一些性质进行探究。 回答下列问题:
(1)配制0.5 mol·L-1 FeSO4溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用_____________________________。
该实验小组做如下实验。
实验序号 | 操作及现象 |
ⅰ | 取2 mL上述FeSO4溶液于试管中,逐滴加入少量0.1 mol·L-1 Na2S 溶液,产生大量黑色沉淀 |
ⅱ | 取2 mL上述FeSO4溶液于试管中,加入2滴1 mol·L-1 KSCN溶液无现象,通入一段时间O2,溶液变为浅红色 |
ⅲ | 重复实验ⅱ,向浅红色溶液中加入5% H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
(2)进一步研究证实,黑色沉淀的主要成分是FeS。Na2S 溶液呈碱性,FeSO4溶液与其反应不生成Fe(OH) 2而生成FeS的可能原因是_____________________。
(3)用离子方程式表示步骤ⅱ中溶液变红的原因:___________、_____________。
(4)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a. Fe3+ 被H2O2还原 b. SCN- 被O2氧化 c. SCN- 被H2O2氧化
乙同学根据上述实验现象认为假设b不成立,他依据的现象是________________。
甲同学利用上述部分试剂,通过以下实验验证了假设c成立。请将以下实验操作及现象补充完整。
步骤 | 试剂及操作 | 现 象 |
i | 取褪色后溶液一份滴加FeCl3溶液 | ①_________ |
ii | ② _________________ | ③_________ |
(5)为探究硫酸亚铁的分解产物,将硫酸亚铁放入装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

① C、D中的溶液依次是__________、________(填字母标号)。
a.品红溶液 b.NaOH溶液 c.BaCl2 溶液
d.Ba(NO3)2 溶液 e.浓H2SO4
② C、D中有气泡冒出,并可观察到的现象分别是____________ 、______________。
③ 写出硫酸亚铁高温分解反应的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是空气的主要污染物之一,研究氮氧化物的性质对于防治空气污染有重要意义。回答下列问题:
(1)已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1
写出NO与臭氧(O3)反应生成NO2的热化学方程式______________________。
(2)温度为T1时,在三个容积均为1L的密闭容器中仅发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0
2NO2(g) △H<0
实验测得:v正=v(NO)消耗= 2v(O2) 消耗= k正c2(NO)·c(O2),v逆=v(NO2) 消耗= k逆c2 (NO2),k正、k逆为速率常数,受温度影响。

①温度为T1时, k正/k逆=___________;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m___________n(填“>”、“<“或“=”)。
②若容器Ⅱ中达到平衡时 c(NO2)/c(NO)=1,则NO的转化率为___________,x=___________。
③容器Ⅲ中起始时v正___________v逆(填“>”、“<”或“=”),理由是___________。
④T1时,在1L密闭容器中按照一定比例充入NO(g)和O2(g),达到平衡时NO2(g)的体积分数Φ(NO2)随n(NO)/n(O2)的变化如图所示,则A、B、C三点中NO的转化率最大的是___________;当n(NO)/n(O2)=2.3时,达到平衡时Φ(NO2)可能是D、E、F三点中的___________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com