
| A. | 乙醇与金属钠反应时,是乙醇分子中羟基中的O-H键断裂 | |
| B. | 检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 | |
| C. | 向待测液中加入饱和碳酸钠溶液鉴别乙酸、乙酸乙酯、乙醇 | |
| D. | 向苯和苯酚混合溶液中滴加过量浓溴水除去混合溶液中的苯酚 |
分析 A.乙醇中含-OH,与Na反应时O-H键断裂;
B.无水硫酸铜遇水变蓝;
C.乙酸、乙酸乙酯、乙醇分别与碳酸钠混合的现象为:气体生成、分层、不分层;
D.溴、三溴苯酚均易溶于苯.
解答 解:A.乙醇中含-OH,与Na反应时O-H键断裂,生成乙醇钠和氢气,故A正确;
B.无水硫酸铜遇水变蓝,则检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水,故B正确;
C.乙酸、乙酸乙酯、乙醇分别与碳酸钠混合的现象为:气体生成、分层、不分层,现象不同可鉴别,故C正确;
D.溴、三溴苯酚均易溶于苯,不能除杂,应加NaOH溶液、分液,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物官能团与性质的关系为解答关键,注意有机反应的判断及有机物分离提纯,侧重分析与应用能力的考查,题目难度不大.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 气体的总物质的量 | ||
| C. | 消耗1摩尔A同时生成1摩尔D | D. | 混合气体的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
| 锂 | X | Y | |
| 失去第1个电子 | 519 | 502 | 580 |
| 失去第2个电子 | 7296 | 4570 | 1820 |
| 失去第3个电子 | 11799 | 6920 | 2750 |
| 失去第4个电子 | 9550 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | ZnO | C. | Zn | D. | Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | Q的一种核素质量数是A,则其中子数是A-17 | |
| B. | 由Z与Y组成的物质在熔融时能导电 | |
| C. | W简单阴离子失电子能力比Q简单阴离子强 | |
| D. | 由X元素组成的单质有多种,它们之间互称同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
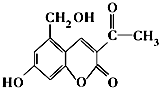
| A. | 亮菌甲素中含有四种官能团 | |
| B. | 亮菌甲素不能与NaHCO3溶液发生反应 | |
| C. | 1 mol亮菌甲素在一定条件下与NaOH溶液完全反应最多能消耗2 mol NaOH | |
| D. | 每个亮菌甲素分子在一定条件下与足量H2反应后的产物有3个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑦ | C. | ⑤⑥⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com