


科目:高中化学 来源: 题型:
 Ⅰ.室温时1L 0.01mol?L-1的硫酸氢钠溶液的pH为
Ⅰ.室温时1L 0.01mol?L-1的硫酸氢钠溶液的pH为| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源:甘肃省张掖中学2007届高三年级模拟训练、化学试卷 题型:022
(1)室温下,0.01mol/L的硫酸氢钠溶液的pH为________,在其中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为________.
(2)室温下取0.2mol·L-1HCl溶液与0.2mol·L-1MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中水电离出的c(H+)________0.2mol·L-1HCl溶液中水电离出的c(H+)(填“>”、“<”、或“=”).
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)—c(M+)=________mol·L-1c(H+)-c(MOH)=________mol·L-1
查看答案和解析>>
科目:高中化学 来源:江苏省邗江中学2006~2007学年度第一学期高三化学期中试卷(旧人教) 旧人教 题型:022
(1)室温下,0.01mol/L的硫酸氢钠溶液的pH为________,在其中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为________.
(2)室温下取0.2mol·L-1HCl溶液与0.2mol·L-1MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中水电离出的c(H+)________0.2mol·L-1HCl溶液中水电离出的c(H+)(填“>”、“<”、或“=”).
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)—c(M+)=________mol·L-1,c(H+)-c(MOH)=________mol·L-1
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省大同市实验中学高二上学期期中考试化学试卷 题型:填空题
(1)室温下PH=2的某强酸稀释100倍,PH=_____,PH=12的某强碱稀释100倍,PH=____
(2)室温下,PH=2的HCl与PH=12的氨水等积混合后,溶液的PH_ __7(填>,<或=),原因是 _______________________________________________________________________________
__7(填>,<或=),原因是 _______________________________________________________________________________
(3)室温下,0.01mol/L的HCl与0.01mol/L的氨水混合后,溶液的PH___7(填>,<或=),原因是_______________________________________________________________________
(4)室温下,将PH=5的H2SO4溶液稀释10倍C(H+):C(SO42-)=_________
将稀释后的溶液再稀释100倍,C(H+):C(SO42-)=_________
(5)MOH和ROH两种一元碱的水溶液分别加水稀释时,PH变化如右图:下列叙述中正确的是()
A:MOH是一种弱碱
B:在x点,MOH完全电离
C:在x点C(M+)=C(R+)
D:稀释前ROH溶液中C(OH-)是MOH溶液中C(OH-)的10倍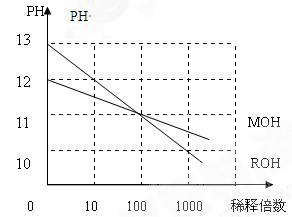
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com