
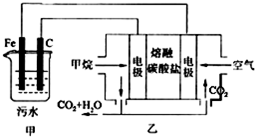
 工业上常用Fe做电极电解处理含Cr2O72-的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去.某科研小组用该原理处理污水,设计装置如图所示.下列说法不正确的是( )
工业上常用Fe做电极电解处理含Cr2O72-的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去.某科研小组用该原理处理污水,设计装置如图所示.下列说法不正确的是( )| A、实验时若污水中离子浓度较小,导电能力较差,可加入适量的NaOH |
| B、燃料电池中若有1.6g CH4参加反应,则甲中C电极理论上生成气体体积为8.96L(标准状况下) |
| C、该燃料电池中阴离子移向甲烷一极 |
| D、甲中阳极附近溶液中的离子反应方程式是:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
| 1.6g |
| 16g/mol |


科目:高中化学 来源: 题型:
| A、结晶时,若溶质的溶解度越大,或溶液的浓度越高、或溶剂的蒸发速度越快,析出的晶粒就越细大 |
| B、用移液管量取液体,吸取液体后,将移液管垂直放入容器中,管尖与容器内壁不得接触,松开食指使溶液全部流出 |
| C、在温水瓶中加入Na2CO3溶液泡浸后加入盐酸能除去内壁CaSO4 |
| D、在两支试管中分别加1mL无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷和乙烯可以用溴水鉴别 |
| B、煤油是石油的分馏产品,可用于保存少量的钠 |
| C、棉花、蛋白质和油脂都是高分子化合物,水解产物均为电解质 |
| D、用饱和碳酸钠溶液可除去乙酸乙酯中混有的乙酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2 mol?L-1 Na2CO3溶液中:c (OH-)=c (HCO3-)+c (H+)+c (H2CO3) |
| B、常温时,将等体积的盐酸和氨水混合后,pH=7,则c (NH4+)>c (Cl-) |
| C、同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3?H2O,c(NH4+)由大到小的顺序是:①>③>②>④ |
| D、含有NH4+、Cl-、OH-、H+的溶液中,离子浓度一定是c (Cl-)>c (NH4+)>c (H+)>c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属性Y>R,则Y的最高价氧化物水化物的酸性高于R的最高价氧化物水化物的酸性 |
| B、在Z、Y形成的两种离子化合物中阴阳离子的个数比分别为1:2和1:1 |
| C、原子半径由大到小排列的是:Z>R>W>Y>X |
| D、Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素X位于第2周期第ⅣA族 |
| B、元素X分别与Y、Z形成的化合物都不止一种 |
| C、单核离子半径大小顺序:X>Y>Z |
| D、Z的最简单氢化物的稳定性比X的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com