
【题目】A、B、C、D、E为短周期元素,原子序数依次增大.其中A与E同主族,B的最外层电子数是次外层电子数的2倍,C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X.A、B、D、E可组成化合物A2D2、B2A2、E2D2 , 它们都含有非极性共价键.
(1)C元素在周期表中的位置是 , 写出B的最高价氧化物的电子式 .
(2)X的水溶液显(填“酸”、“碱”或“中”)性,理由是(用离子方程式表示) , 溶液中各种离子浓度由大到小的顺序为 .
(3)A、B、D、E四种元素组成的化合物中原子个数最少的化合物的化学式为 .
(4)火箭推进器中装有液态的C2A4和液态A2D2 , 它们发生化学反应时生成气态C单质和水蒸气,并放出大量的热.已知0.4mol液态C2A4跟液态A2D2完全反应时,放出256.6kJ热量,该反应的热化学方程式为 .
【答案】
(1)第二周期VA族;![]()
(2)酸;NH4++H2O?H++NH3 . H2O;c(NO3﹣)>c(NH4+)>c(H+)>c(OH﹣)
(3)HCOONa
(4)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣641.5kJ/mol
【解析】解:A、B、C、D、E为短周期元素,原子序数依次增大.B的最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则B为碳元素;C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X,则C为N元素,X为NH4NO3;A、B、D、E可组成化合物A2D2、B2A2、E2D2 , 它们都含有非极性共价键,其中A与E同主族,可推知A为H元素,D为O元素,E为Na.
(1.)C为N元素,在周期表中的位置是:第二周期VA族,B的最高价氧化物为CO2 , 电子式为 ![]() ,所以答案是:第二周期VA族;
,所以答案是:第二周期VA族; ![]() ;
;
(2.)X为NH4NO3 , 其水溶液中NH4+水解:NH4++H2OH++NH3 . H2O,显酸性,溶液中各种离子浓度由大到小的顺序为:c(NO3﹣)>c(NH4+)>c(H+)>c(OH﹣),所以答案是:酸;NH4++H2OH++NH3 . H2O;c(NO3﹣)>c(NH4+)>c(H+)>c(OH﹣);
(3.)H、C、O、Na四种元素组成的化合物中原子个数最少的化合物的化学式为HCOONa,所以答案是:HCOONa;
(4.)火箭推进器中装有液态的N2H4和液态H2O2 , 它们发生化学反应时生成气态N2和水蒸气,0.4mol液态肼完全放出256.6KJ的热量,则1mol液态肼放出的热量为256.6kJ× ![]() =641.5kJ,反应的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.5kJ/mol,
=641.5kJ,反应的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.5kJ/mol,
所以答案是:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣641.5kJ/mol.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】已知:①RNH2+R′CH2Cl ![]() RNHCH2R′+HCl(R和R′代表烃基) ②苯的同系物能被高锰酸钾氧化,如:
RNHCH2R′+HCl(R和R′代表烃基) ②苯的同系物能被高锰酸钾氧化,如: ![]()
![]()
![]()
③ ![]()
![]()
![]() (苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
(苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示: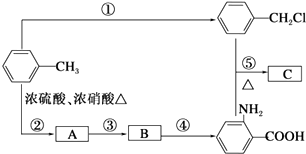
请回答下列问题:
(1)B物质的结构简式是 .
(2)写出反应①、②的化学方程式: ①;
② .
(3)反应①~⑤中,属于取代反应的是(填反应序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. NH3易液化
B. Cu既能溶于浓硝酸又能溶于稀硝酸,且硝酸的还原产物为氮的氧化物
C. Cu在加热的条件下能溶于浓硫酸
D. 向胆矾晶体中加入浓硫酸,晶体由蓝色变为白色体现了浓硫酸的脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭烧瓶中,在25℃时存在着平衡:2NO2N2O4(正反应放热).把烧瓶置于100℃的水中,则下列几项性质中不会改变的是( ) ①颜色;②平均分子量;③质量;④压强;⑤密度.
A.①和③
B.②和④
C.④和⑤
D.③和⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学在实验室研究铝与氯化铜溶液的反应。
实验操作 | 实验现象 |
| ①红色物质附着于铝片表面 ②铝片表面逸出大量无色气体,放出大量的热 ③烧杯底部出现红色沉淀和白色沉淀 |
(1)打磨铝片的目的是__________。
(2)现象①和现象③中的红色物质均为Cu,生成该物质的化学方程式为______________。
(3)经检验,现象②中的无色气体为氢气。甲同学猜测可能是氯化铜溶液显酸性,经pH计检验,pH_____7,证实了甲的猜想。
(4)探究白色沉淀的化学成分。
乙同学通过查阅资料认为白色沉淀可能是氯化亚铜(CuCl)。
CuCl中铜元素的化合价是________。
【查阅资料】
①CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl-。
②Cu(NH3)2+在空气中易被氧化变为蓝色;Cl-可与硝酸银溶液反应,产生白色沉淀。
【进行实验】
①取烧杯底部的白色沉淀,充分洗涤;
②向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
③取其中一份无色溶液……
④将另一份无色溶液放置于空气中……
以上步骤③的实验方案是________;步骤④的现象是________。
【得出结论】通过实验可以确定,该白色固体是CuCl。
【反思与评价】Al和CuCl2溶液反应为什么会出现CuCl呢?
丙同学猜测:可能是Cu与CuCl2溶液反应生成了CuCl。
丙同学为了验证猜想,取Cu粉与15% CuCl2溶液混合,无白色沉淀产生。
(5)丙通过分析Al与CuCl2溶液反应的实验现象,改进了实验,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是________。
(6)丁同学认为丙同学的实验还不够严谨,还应考虑________对Cu与CuCl2溶液反应的影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X原子核外有n个电子层,X是位于第ⅣA族短周期元素,下列有关说法正确的是( )
A. 1≤n≤3
B. X原子最外层有4个电子
C. X可能是金属元素
D. X原子易得到电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两元素的原子分别失去2个电子形成稳定结构时,A吸收的能量大于B吸收的能量;C、D两元素的原子分别得到一个电子形成稳定结构时,D放出的能量大于C放出的能量。若A、B、C、D间分别形成化合物时,属于离子化合物可能性最大的是
A.AD2 B.BC2 C.AC2 D.BD2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值.下列判断正确的是( )
A.32克O2和O3组成的混合气体中含有的氧原子数目为2NA
B.常温常压下,22.4 L乙醇含有的分子数目为NA
C.1 mol Na变为Na+时得到的电子数目为NA
D.44克14C16O2含氧原子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com