
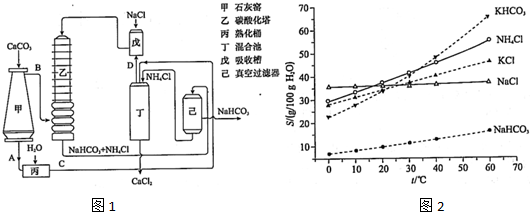
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、全部 | B、只有①③④ |
| C、只有②④⑤ | D、只有①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mL | B、5mL |
| C、大于5mL | D、小于5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
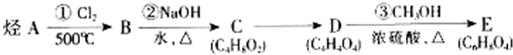
| ④ |
| ⑤KMnO4/H+ |
| ⑥ |
| ⑦酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:

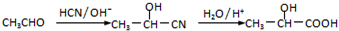
查看答案和解析>>
科目:高中化学 来源: 题型:
 NO3-+
NO3-+ ═
═ Fe2++
Fe2++ NH4++
NH4++
查看答案和解析>>
科目:高中化学 来源: 题型:

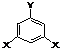 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、40% | B、50% |
| C、70% | D、80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com