
分析 (1)辉铜矿(Cu2S)在空气中高温焙烧即可得到铜和还原性的气体二氧化硫;
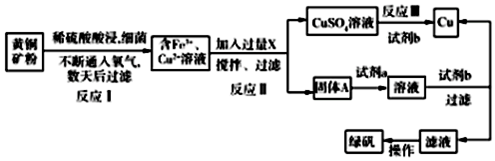
(2)运用湿法炼铜的同时制绿矾(FeSO4•7H2O)的工艺:将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成含Fe3+,Cu2+的溶液,加入试剂XCuO、Cu(OH)2、CuCO3促进铁离子水解生成氢氧化铁沉淀与铜离子分离,得到固体A氢氧化铁和硫酸铜溶液,硫酸铜溶液与铁粉得到铜单质,氢氧化铁再用稀硫酸溶解,再用铁粉还可得C为硫酸亚铁溶液,亚铁离子易被氧化,再通过蒸发浓缩、隔绝降温结晶、过滤、洗涤、干燥得绿矾,据此分析作答.
解答 解:(1)火法炼铜发生反应的化学方程式为:Cu2S+O2═2Cu+SO2;
故答案为:Cu2S+O2═2Cu+SO2;
(2)酸浸时,通过增大酸的浓度、粉碎矿石或者升高温度或者进行搅拌都可以提高浸取率;
故答案为:增大酸的浓度、提高温度、搅拌等;加入过量CuO、Cu(OH)2、CuCO3 调节溶液PH,使铁离子变成氢氧化铁沉淀,则试剂X为CuO、Cu(OH)2、CuCO3,制取的是绿矾,不能引进新的杂质,溶解氢氧化铁用稀硫酸,试剂a的最佳选择是稀硫酸;
故答案为:增大酸的浓度、提高温度、搅拌等;CuO、Cu(OH)2、CuCO3;稀H2SO4;
(3)反应I的化学方程式为:4CuFeS2+17O2+2H2SO4═4CuSO4+2Fe2(SO4)3+2H2O;
故答案为:4,17,2,4,2,2;
(4)已知溶液的pH=4,则c(H+)=10-4mol/L,c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=2.6×10-38=c(Fe3+)×c3(OH-),所以c(Fe3+)=2.6×10-8mol/L;已知溶液中氢氧根离子的浓度为10-10mol/L,若要此时不出现Cu(OH)2沉淀,则Qc=c(Cu2+)×c2(OH-)<Ksp[Cu(OH)2]=2.2×10-20,则溶液中的c(Cu2+)=2.2;
故答案为:2.6×10-8;2.2;
(5)滤液为硫酸亚铁溶液,亚铁离子易被氧化,故再通过蒸发浓缩、隔绝降温结晶、过滤、洗涤、干燥得绿矾;
故答案为:蒸发浓缩、隔绝空气冷却结晶、过滤.
点评 本题考查了工业生成铜和绿矾的工业流程,涉及了实验操作、化学方程式书写、反应方程式的书写、除杂质、氧化还原反应、溶度积的有关计算等,综合性较强,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 铝元素是地壳中含量最多的元素 | |
| B. | 工业炼铝采用电解熔融的铝土矿的方法 | |
| C. | 冰晶石能使氧化铝熔融温度降低 | |
| D. | 工业上可用电解熔融氯化铝制取金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分 | |
| B. | SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子 | |
| C. | SiO2是酸性氧化物,能与水反应生成硅酸 | |
| D. | 硅元素是构成矿物岩石的主要成分之一,其化合态几乎全部是氧化物和硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物能量总和大于生成物能量总和 | |
| B. | 反应中生成1mol水蒸气放出285.8 kJ的热量 | |
| C. | 2H2O(1)=2H2(g)+O2(g)△H=+571.6 kJ.mol-1 | |
| D. | 当反应中有2 mol H-H键断裂,该反应放出571.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅单质用于制作光导纤维 | |
| B. | Al2O3熔点很高,可用作耐火材料 | |
| C. | SO2可以用来漂白面条 | |
| D. | N2与O2在放电条件下直接化合生成NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com