
Fe3+可以与SCN-、CN-、F-有机分子等形成很多的配合物。
(1)写出基态Fe3+的核外电子排布式 。
(2)CN-中碳原子的杂化方式为 。
(3)已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为 。
(4)写出一种与SCN-互为等电子体的分子 。(用化学式表示)
(5)下图是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示)。
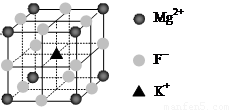
(6)F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如下图)。该晶体的化学式为 。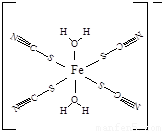
(12分)每空2分
(1)[Ar]3d5 (2) sp (3)4∶3 (4)CS2或CO2
(5)

(6)KMgF3
【解析】
试题分析:(1)根据所学知识,Fe3+的核外电子排布式为[Ar]3d5。(2)CN-中C原子价层电子对个数="1+(1/2)"
(4+1-1×3)=2,所以采取sp杂化。(3)(CN)2中π键和σ键的个数比为4∶3。(4)SCN-价电子数为16,原子数为3,其等等电子体分子有CS2或CO2。(5)观察图像得知,N、C和S都达到了8电子结构,故该配合物中的配位键为 。(6)观察图像得,Mg2+为立方体的顶点,个数为8×(1/8)=1,K+位于中心,个数为1,F-位于边中间,个数为12×(1/4)=3,故该晶体的化学式为KMgF3。
。(6)观察图像得,Mg2+为立方体的顶点,个数为8×(1/8)=1,K+位于中心,个数为1,F-位于边中间,个数为12×(1/4)=3,故该晶体的化学式为KMgF3。
考点:配合物的成键情况;共价键的形成及共价键的主要类型;等电子体;晶胞的计算
点评:本题考查较为综合,设计配位键、晶胞的计算等知识,题目难度中等,注意原子核外电子排布与物质性质的关系,当价层电子轨道处于全空、全充满、半充满时,较稳定。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012--2013学年新疆乌鲁木齐市一中高二下学期期中考试化学试卷(特长班)(带解析) 题型:填空题
根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的外围电子排布式为: 。
(2)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的
外围电子排布是4s24p4,该元素的名称是 。
(3)根据VSEPR模型,H3O+的分子立体结构为: 。
(4)含有非极性键的离子化合物(任写一种) 。
(5)含有极性键和非极性键的极性分子(任写一种) 。
(6)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成红色.该反应在有的教材中用方程式FeCl3+3KSCN===Fe(SCN)3+3KCl表示,经研究表明Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1∶3的个数比配合,还可以其他个数比配合.若Fe3+与SCN-以个数比1∶1配合所得离子显红色.含该离子的配合物的化学式是 .
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省高三上学期第三次月考理综化学试卷(解析版) 题型:填空题
(1)Fe3+可以与SCN-、CN-、F-、有机分子等形成很多的配合物。
①写出基态Fe3+的核外电子排布式 。
②已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为 。
③下图是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示)。
④F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如下图)。该晶体的化学式为 。


(2)氨气是一种重要的化工原料。
①液氨和水类似,也能发生电离:NH3+NH3 NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
NH4++NH2-,其离子积常数为l.0×l0-30。现将2.3g金属钠投入1.0 L液氨中,钠完全反应生成NaNH2,假设溶液的体积不变,所得溶液中NH4+的浓度
为 。
②已知:N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-l
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-908 kJ·mol-l
写出氨气被一氧化氮氧化生成氮气和气态水的热化学方程式: 。
(3)在下图装置中,若通电一段时间后乙装置左侧电极质量增加。

①下列说法错误的是 ;
A.乙中左侧电极反应式:Cu2++2e-=Cu
B.电解一段时间后,装置丙的pH减小
C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态
D.电解一段时间后,向乙中加入0.1molCu(OH)2可使电解质溶液复原,则电路中通过的电子为0.2mol②若将甲中溶液换成MgCl2,则电解总反应的离子方程式为 ;
③若Cu电极上质量增加2.16 g, 甲溶液体积为200mL, 则甲溶液的pH= 。
查看答案和解析>>
科目:高中化学 来源:2012--2013学年新疆乌鲁木齐市高二下学期期中考试化学试卷(特长班)(解析版) 题型:填空题
根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的外围电子排布式为: 。
(2)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的
外围电子排布是4s24p4,该元素的名称是 。
(3)根据VSEPR模型,H3O+的分子立体结构为: 。
(4)含有非极性键的离子化合物(任写一种) 。
(5)含有极性键和非极性键的极性分子(任写一种) 。
(6)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成红色.该反应在有的教材中用方程式FeCl3+3KSCN===Fe(SCN)3+3KCl表示,经研究表明Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1∶3的个数比配合,还可以其他个数比配合.若Fe3+与SCN-以个数比1∶1配合所得离子显红色.含该离子的配合物的化学式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com