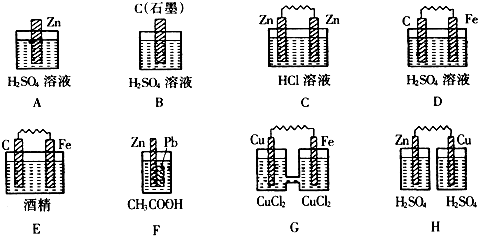
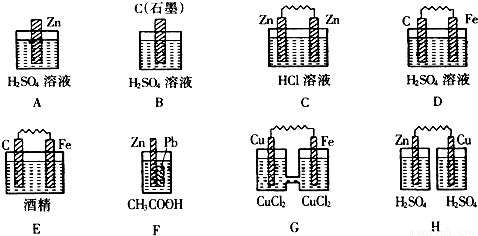
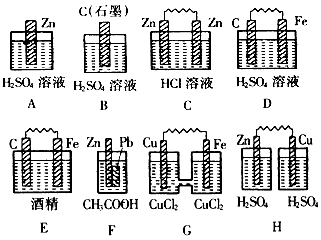
分析:(1)原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应;
(2)由铜、锌和稀盐酸组成的原电池中,锌易失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应.
解答:解:(1)原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,
A.该装置中没有两个活泼性不同的电极,所以不能形成原电池,故A错误;
B.该装置中没有两个活泼性不同的电极,且不能自发的进行氧化还原反应,所以不能构成原电池,故B错误;
C.该装置中,两个电极材料相同,所以不能构成原电池,故C错误;
D.该装置符合原电池的构成条件,所以能构成原电池,故D正确;
E.该装置不能自发的进行氧化还原反应,所以不能构成原电池,故E错误;
F.该装置符合原电池的构成条件,所以能构成原电池,故F正确;
G.该装置符合原电池的构成条件,所以能构成原电池,故G正确;
H.该装置不能形成闭合回路,所以不能构成原电池,故H错误;
故选:D、F、G;
(2)由铜、锌和稀盐酸组成的原电池中,铜不易失电子而作正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,锌易失电子发生氧化反应而作负极,电极反应式为:Zn-2e-=Zn2+,
故答案为:正;还原; 2H++2e-=H2↑;负;氧化反应;Zn-2e-=Zn2+.
点评:本题考查了原电池原理,明确原电池的构成条件、正负极的判断方法、正负极上得失电子是解本题关键,难度不大.



 阅读快车系列答案
阅读快车系列答案