
【题目】乙醇在化学反应中有如图所示的共价键的断裂方式,以下有关乙醇的反应中,其对应价键断裂方式正确的是( )
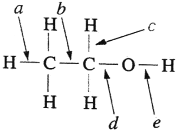
A.Na与乙醇反应时断裂的价键是e
B.在浓硫酸作用下加热到170 ℃时断裂的价键是ae
C.在催化剂作用下和氧气反应时断裂的价键是cd
D.在浓硫酸作用下加热到140 ℃时断裂的价键是be
科目:高中化学 来源: 题型:
【题目】硫氰酸盐在化学工业中应用广泛。
(1)组成硫氰酸根(SCN -)的三种元素的部分性质见下表:
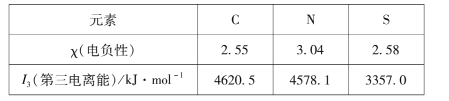
①硫氰酸根中碳元素的化合价为____。
②碳元素的I1、I2均比氮小。但I3却比氮高,其原因是____。
(2)晶体场理论认为,基态离子的d轨道存在未成对电子时,d电子发生d-d跃迁是金属阳离子在水溶液中显色的主要原因。下列硫氰酸盐的水溶液有颜色的是____(填标号)。
A KSCN B Fe(SCN)3 C Ni(SCN)2 D Zn(SCN)2
(3)NH4SCN广泛应用于医药、印染等行业,隔绝空气加热后可分解生成NH3、CS2、H2S、(CN)2及N2。
①SCN-可能具有[S-C≡N]-和____(填结构式)两种结构,中心原子碳的轨道杂化方式均为____。
②(CN)2熔沸点高于N2的原因是____。
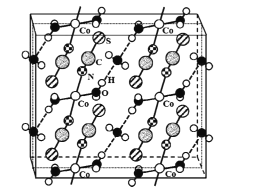
(4)硫氰酸钴可用于毒品检验。其水合物晶体的晶胞结构如下图所示(所有原子都不在晶胞的顶点或棱上)。
①晶体中微粒间作用力有____(填标号)。
A 金属键 B 氢键 C 非极性键 D 极性键 E 配位键
②晶体的化学式为____。
③硫氰酸钴晶体属于正交晶系,晶胞参数分别为a nm、b nm.c nm,α=β=γ=90°。晶体的摩尔质量为M g·mol-1。则晶体密度=____g·cm-3(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):

已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;

(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是________________。
(2)D→E反应的化学方程式是____________。
(3)A→B反应所需的试剂是________________。
(4)G→H反应的化学方程式是____________。
(5)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有________种,其中任意1种的结构简式是________。
(7)J可合成高分子化合物,该高分子化合物的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中铋元素的数据如图,下列说法正确的是( )
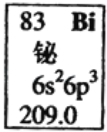
A. Bi元素的质量数是209
B. Bi元素的相对原子质量是209.0
C. Bi原子6p亚层有一个未成对电子
D. Bi原子最外层有5个能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏伽德罗常数的值,下列说法正确的是
A.常温下,1mol 的 Fe 与足量的浓硫酸反应转移的电子数为 3NA
B.1L1mol·L-1 的 Na2CO3 溶液中含有碳酸根的数目为 NA
C.标准状况下,22.4L 的 Cl2 通入水中,转移的电子数为 NA
D.常温常压下,22.4L 的甲烷气体含有的氢原子的数目小于 4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,往 H3PO4 溶液中滴加 NaOH 溶液,体系中含磷各物种所占的物质的量分数 (α)随溶液pH 变化的关系如图所示。下列有关说法不正确的是
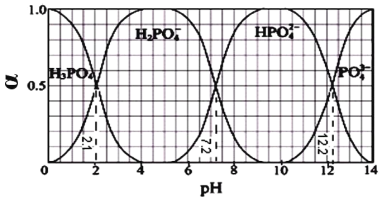
A.为尽可能得到较纯的 NaH2PO4,pH 应控制在 4~5.5 左右
B.在 pH<7.2 的溶液中,c (H2PO4 - )>c (HPO42 -)
C.当 pH=7.2 时,H2PO4 - 与 HPO42 -的物质的量相等且等于原溶液磷酸物质的量的一半
D.pH=13 时,溶液中各微粒浓度大小关系为:c (Na+)>c (PO43-)>c (HPO42-)>c (OH-)>c (H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较结合 H+能力的相对强弱:H2O_____NH3 (填“>”、“<”或“=”);用一个离子 方程式说明 H3O+和 NH4+给出 H+能力的相对强弱_____。
(2)NaOCN 是离子化合物,各原子均满足 8 电子稳定结构。写出 NaOCN 的电子式_____。
(3)乙酸汽化时,测定气体的相对分子质量,有数据表明其摩尔质量变为 120g·mol-1,从结构上 分析其可能的原因是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中,一定相等的是()
A.相同物质的量浓度的CH3COOH和CH3COONa溶液中的c(CH3COO-)
B.相同质量的钠分别完全转化为Na2O和Na2O2时转移的电子数
C.相同物质的量的丙烷和2-甲基丙烷中所含C-H键的数目
D.标准状况下,相同体积的乙炔和苯中所含的H原子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com