
对于处于化学平衡状态的反应C(s)+H2O(g)⇌CO(g)+H2(g)△H>0,既要提高反应速率又要提高H2O的转化率,下列措施中可行的是( )
|
| A. | 增大H2O(g)的浓度 | B. | 降低压强 |
|
| C. | 升温 | D. | 使用合适的催化剂 |
考点:
化学平衡的影响因素.
专题:
化学平衡专题.
分析:
既要提高反应速率又要提高H2O的转化率,平衡正向移动,该反应为吸热反应,应升高温度,以此来解答.
解答:
解:A.增大H2O(g)的浓度,平衡正向移动,反应速率增大,但转化率减小,故A不选;
B.降低压强,反应速率减小,平衡正向移动,故B不选;
C.该反应为吸热反应,升高温度,反应速率加快,平衡正向移动,转化率提高,故C选;
D.使用合适的催化剂,对平衡移动无影响,转化率不变,故D不选;
故选C.
点评:
本题考查压强对反应速率及平衡的影响,把握反应的特点、物质的状态及压强对速率的影响即可解答,选项A为易错点,题目难度不大.


科目:高中化学 来源: 题型:
下列各变化中,属于原电池反应的是( )
|
| A. | 在空气中金属铝表面迅速氧化形成保护层 |
|
| B. | 镀锌铁表面有划损时,也能阻止铁被氧化 |
|
| C. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 |
|
| D. | 浓硝酸比稀硝酸更容易氧化金属铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷与氧可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P﹣P:a kJ•mol﹣1、P﹣O:b kJ•mol﹣1、P=O:c kJ•mol﹣1、O=O:d kJ•mol﹣1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
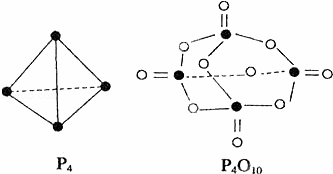
|
| A. | (6a+5d﹣4c﹣12b)kJ•mol﹣1 | B. | (4c+12b﹣6a﹣5d)kJ•mol﹣1 |
|
| C. | (4c+12b﹣4a﹣5d)kJ•mol﹣1 | D. | (4a+5d﹣4c﹣12b)kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Zn﹣MnO2干电池应用广泛,其电解质溶液是ZnCl2﹣NH4Cl混合溶液.
(1)该电池的负极材料是 .负极的电极反应为
(2)若ZnCl2﹣NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 .欲除去Cu2+,最好选用下列试剂中的 (填代号).
a.NaOH b.Zn c.Fe d.NH3•H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,固定体积的容器中充入1mol SO2和1mol O2,再加入少量的NO,在体系中发生①2NO+O2=2NO2;②SO2+NO2=SO3+NO,下列说法中不正确的是( )
|
| A. | 体系中的总反应是:2SO2+O2⇌2SO3 |
|
| B. | 在反应过程中NO是催化剂 |
|
| C. | NO参与反应历程,降低反应活化能,加快反应速率 |
|
| D. | NO的引入可以增加SO2的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组试剂(括号内的是滴加试剂)做溶液导电性实验的过程中,可以观察到灯泡由亮变暗直至熄灭,然后又逐渐变亮的是( )
|
| A. | BaCl2溶液(稀硫酸) | B. | 氨水(醋酸溶液) |
|
| C. | Ba(OH)2溶液[Ba(HCO3)2溶液] | D. | Ba(OH)2溶液(NaHSO4溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的FeO、Fe、Fe2O3的混合物中加入100ml1mol/L的盐酸,恰好使混合物完全溶解,放出224ml标况下的气体,在所得溶液中滴入硫氰化钾溶液无血红色出现(即无3价铁).若用足量CO在高温下还原同质量的此混合物,能得到铁的质量是()
A. 11.2g B. 5.6g C. 2.8g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量。下列说法正确的是

A. T1>T2 B. 加入BaCl2固体,可使a点变成c点
C. c点时,在T1、T2两个温度下均有固体析出 D. a点和b点的Ksp相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com